题目内容
【题目】目前人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。
4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
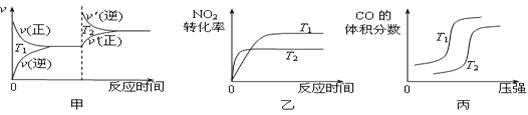
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 (填代号)。
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g) ![]() N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(CO
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。
电池反应为:4NH3+3O2=2N2+6H2O;
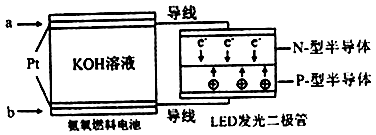
请写出通入a气体一极的电极反应式为 ;每消耗3.4g NH3转移电子的物质的量为 。
【答案】(1)乙;
(2)①0.015mol·L-1·min-1;0.56(或9/16)②bc;③降低;<;
(3)2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)ΔH=–87.0kJ·mol-1
(4)2NH3+6OH-–6e-=N2+6H2O 0.6mol
【解析】
试题分析:(1)甲:升高温度,化学平衡逆向移动,化学反应速率会迅速增大,会离开原来的速率点,错误;乙:升高温度,化学反应速率会迅速增大,所以T2 时先达到化学平衡状态,并且由于该反应的正反应是放热反应,所以升高温度,化学平衡向吸热的逆反应方向移动,使二氧化氮的转化率减小,正确;丙:对于该反应来说,正反应是气体体积减小的反应,在温度不变时,增大压强,平衡正向移动,一氧化碳的体积分数会减小,错误;(2) ①根据表格数据可知:在20min内CO2的浓度增大0.30mol/L,则用CO2的浓度改变表示反应速率是V(CO2)=0.30mol/L÷20min=0.015mol/(L·min);反应达到平衡时,各种物质的浓度分别是:c(NO)=0.48mol/L;c(N2)=c(CO2)=0.36mol/L,所以在该温度下的化学平衡常数K= c(N2)·c(CO2)÷c2(NO)= (0.36mol/L ×0.36mol/L )÷(0.48mol/L)2=9/16=0.56;②30min后,只改变某一条件,反应重新达到平衡,依据图表数据分析,平衡状态各物质浓度增大,而平衡常数只随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积或加入一定量一氧化氮;故答案为bc;③在原来平衡时,c(NO):c(N2):c(CO2)= 0.48:0.36:0.36=4:3:3,若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,氮气和二氧化碳浓度之比始终为1:1,所以5:3>4:3,说明平衡向逆反应方向移动,升高温度平衡逆向移动,根据平衡移动原理:升高温度,化学平衡向吸热的反应方向移动,说明逆反应是吸热反应,则正反应是放热反应,故△H<0;(3)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH= –87.0 kJ·mol-1;(4) 电池反应为:4NH3+3O2=2N2+6H2O.该电池负极是氨气失电子生成氮气,根据示意图可知a电极是负极,发生氧化反应,发生的电极反应式为2NH3+6OH-– 6e-=N2 + 6H2O,反应中2mol氨气反应电子转移6mol电子,每消耗3.4g NH3的物质的量=13.4g÷17g/mol=0.2mol,所以转移的电子数为0.36NA 。

【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D