题目内容
如图所示,下列叙述中正确的是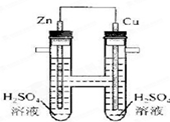
| A.正极发生氧化反应 | B.电子通过导线由铜流向锌 |
| C.负极有O2逸出 | D.铜上有H2逸出 |
D
解析试题分析:该装置是原电池,其中Zn是原电池的负极,Cu是原电池的正极。A.在正极发生还原反应,错误;B.电子由锌通过导线流向铜,错误;C.负极上Zn失去电子产生Zn2+进入溶液,错误;D.在正极铜上氢离子得到电子产生氢气,因此有H2逸出,正确。
考点:考查原电池的反应原理的知识。

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
蓄电池在放电时起原电池作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时的反应: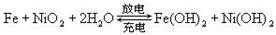
则下列有关对爱迪生蓄电池的推断错误的是
| A.放电时正极附近pH增大 |
B.充电时阴极的电极反应式为: 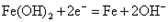 |
| C.放电时电解质溶液中的阴离子向正极方向移动 |
| D.蓄电池的电极可浸入某种碱性电解质溶液中 |
某化学学习小组学习电化学后,设计了下面的实验装置图: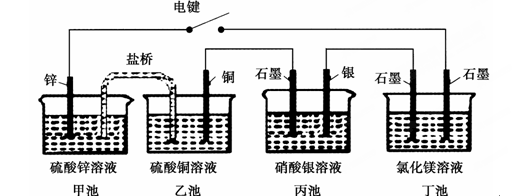
下列有关该装置图的说法中正确的是( )
| A.合上电键后,盐桥中的阳离子向甲池移动 |
| B.合上电键后,丙池为电镀银的电镀池 |
| C.合上电键后一段时间,丙池中溶液的pH增大 |
| D.合上电键后一段时间,当丙池中生成标准状况下560 mL气体时,丁池中理论上最多产生2.9 g固体 |
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是:( )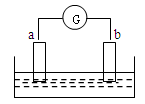
| A.a为负极,是铁片,烧杯中的溶液为硫酸 |
| B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C.a为正极,是碳棒,烧杯中的溶液为硫酸 |
| D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
镁―过氧化氢燃料电池具有能量高、安全方便等优点,其结构示意图如图所示。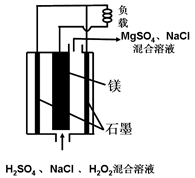
下列有关该电池的叙述中正确的是( )
| A.该电池可以在高温下正常工作 |
| B.电池工作时,正极周围溶液的PH将不断减少 |
| C.电池工作时,H+向负极移动 |
| D.该电池的总反应式为Mg+H2O2+H2SO4=MgSO4+2H2O |
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可简化为:2Li + I2 = 2LiI。下列有关说法正确的是
| A.I2发生氧化反应 | B.碘电极为该电池的正极 |
C.正极反应为:Li –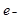 = Li+ = Li+ | D.该电池放电时化学能转化为电能 |