题目内容
下列叙述是某同学做完铜锌原电池实验后得出的结论和认识,正确的是( )
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由铜锌作为电极与硫酸铜溶液组成的原电池中,铜是负极 |
| C.电流通过硫酸溶液,SO42- 向正极移动 |
| D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol 电子通过 |
D
解析试题分析:A、构成原电池正负极的材料不一定都是金属,如锌、石墨和稀硫酸也能构成原电池,故A错误;B、原电池中,易失电子的金属作负极,所以由铜锌作为电极与硫酸铜溶液组成的原电池中,Zn是负极,故B错误;C、原电池放电时,阴离子向负极移动,所以硫酸根离子向负极移动,故C错误;D、负极电极反应为Zn-2e-=Zn2+,根据锌和转移电子关系得转移电子的物质的量=(13g÷65g/mol)×2=0.4mol,故D正确;故选D。
考点:考查原电池原理

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250mL容量瓶中定容成250mL烧碱溶液; |
| B.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂; |
| C.在天平上准确称取烧碱样品mg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为C mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL; |
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写)


 D
D  。
。(2)操作E中的锥形瓶下垫一张白纸的作用是 。
(3)操作D中液面应调整到 。
(4)滴定终点的现象是 。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(6)该烧碱样品的纯度计算式是 。
高铁电池是电动汽车首选的电池之一,该电池的工作原理为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是 ( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是 ( )
| A.高铁电池产生的电流从负极经外电路到达正极 |
| B.正极反应式为Zn+2OH-—2e - =Zn(OH)2 |
| C.负极pH减小,正极pH增大,电解液pH增大 |
| D.每氧化1mol高铁酸钾转移3mol电子 |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
| A.未通电前上述镀锌装置可构成原电池,锌为负极,电镀时锌与电源负极相连为阴极 |
| B.电镀时通过1mol电子,阴极上有0.5mol锌的析出 |
| C.未通电前K+向铁极移动,通电后K+还向铁极移动 |
| D.镀锌层破损后对铁制品失去保护作用 |
下列叙述正确的是
| A.在原电池的正极和电解池的阳极上发生的都是氧化反应 |
| B.实验室用惰性电极电解NaCl溶液,阴、阳两极收集到的气体体积之比为2∶1 |
C.用铜作电极电解稀硫酸,可能发生反应:Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| D.在用惰性电极电解稀硫酸的过程中,溶液pH保持不变 |
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是:( )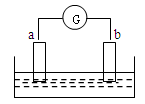
| A.a为负极,是铁片,烧杯中的溶液为硫酸 |
| B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C.a为正极,是碳棒,烧杯中的溶液为硫酸 |
| D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |