题目内容
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是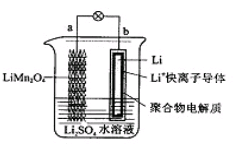
| A.a为电池的正极 |
B.电池充电反应为LiMn2O4 Li1-xMn2O4+xLi Li1-xMn2O4+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
C
解析试题分析:根据题给装置图判断,b电极为原电池的负极,电极反应式为Li—e- Li+,a电极为原电池的正极,电极反应式为Li1-xMn2O4+x Li++x e-
Li+,a电极为原电池的正极,电极反应式为Li1-xMn2O4+x Li++x e- LiMn2O4。A、根据上述分析知,a为电池的正极,正确;B、电池充电反应为LiMn2O4
LiMn2O4。A、根据上述分析知,a为电池的正极,正确;B、电池充电反应为LiMn2O4 Li1-xMn2O4+xLi,正确; C、放电时,a极锰的化合价降低,而锂的化合价不发生变化,错误;D、放电时,溶液中Li+由负极向正极迁移,即从b向a迁移,正确。
Li1-xMn2O4+xLi,正确; C、放电时,a极锰的化合价降低,而锂的化合价不发生变化,错误;D、放电时,溶液中Li+由负极向正极迁移,即从b向a迁移,正确。
考点:考查原电池原理、化学电源。熟练掌握原电池原理,准确判断正、负极,明确两极的电极反应及电池反应是解题的关键。

铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。
下列说法不正确的是
| A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C.铜极上的反应是2H+ + 2e- ="=" H2↑,O2 + 4e- + 4H+ ="=" 2H2O |
| D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
某燃料电池的装置如下图所示,在工作中石墨A电极反应生成一种氧化物Y,下列说法正确的是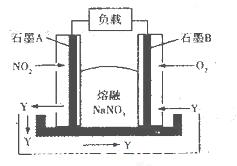
| A.石墨A极为正极,石墨B极为负极 |
| B.Y的化学式可能为NO |
| C.石墨B极上发生氧化反应 |
D.石墨A极的电极反应式为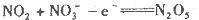 |
关于如图所示装置的叙述,正确的是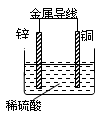
| A.锌是正极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则
A.电流方向:电极IV→ →电极I →电极I |
| B.电极I发生还原反应 |
| C.电极II逐渐溶解 |
| D.电极III的电极反应:Cu2++2e-==Cu |
一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH3OH和O2,下解说法不正确的是
| A.通入CH3OH的电极为负极 |
| B.随着放电的进行,负极附近pH上升 |
| C.每消耗1molCH3OH可以向外电路提供6mol e- |
| D.通入O2的一极电极反应为 4H2O + 2O2 - 8e- = 8OH-。 |
乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2 + O2→ 2CH3CHO。 下列有关说法正确的是( )
| A.该电池为可充电电池 |
| B.电子移动方向:电极a→磷酸溶液→电极b |
| C.正极反应式为:CH2=CH2-2e- + 2OH- → CH3CHO + H2O |
| D.每有0.1mol O2反应,则迁移H+ 0.4mol |
报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH + 3O2 + 4OH—  2CO32— + 6H2O,则下列说法错误的是 ( )
2CO32— + 6H2O,则下列说法错误的是 ( )
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
| A.蓄电池放电时,电路中每转移2 mol电子,最多有1 molPbO2被还原 |
| B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
| C.电解后, c(Na2SO4)不变,且溶液中有晶体析出 |
| D.蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O |