题目内容
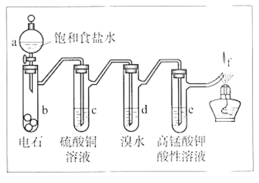
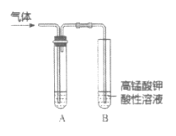
【题目】实验室制备乙炔时,气体中常含有杂质,影响其性质的检验。如图A为除杂装置,B为性质检验装置,回答下列问题:
(1)实验室中制备乙炔的化学方程式:________。
(2)A中试剂:_______。
【答案】CaC2+2H2O=Ca(OH)2+C2H2↑ CuSO4溶液
【解析】
(1)实验室中用电石和水反应制乙炔;
(2)A中试剂主要除杂质气体硫化氢、磷化氢等,排除它们对乙炔与酸性高锰酸钾溶液反应的干扰。
(1) 电石和水反应制乙炔,电石的主要成分是碳化钙,与水反应生成氢氧化钙和乙炔,反应方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑;
答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(2)因为电石含杂质硫化钙、磷化钙,与水反应生成的乙炔中含有硫化氢,磷化氢等,有毒且均可使高锰酸钾溶液褪色,会干扰乙炔与酸性高锰酸钾溶液反应,因此用硫酸铜溶液除去硫化氢,磷化氢杂质气体;
答案为:CuSO4溶液。

练习册系列答案
相关题目