题目内容
【题目】青铜(Cu-Zn)是我国最早大量使用的合金,其中锌是现代工业上常用金属。某废催化剂含58.2%的SiO2(不溶于水和稀酸)、21.0%的ZnO、4.5%的ZnS(不溶于水但溶于稀酸)和12.8%的CuS(不溶于水也不溶于稀酸)。某同学用15.0 g该废催化剂为原料,以稀硫酸和H2O2为试剂,回收其中的锌和铜。
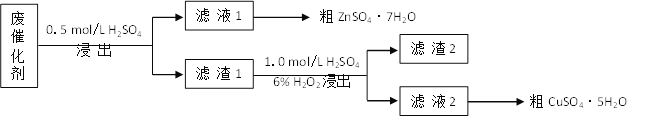
(1)第一次浸出时发生的反应化学方程式是__________。
(2)滤渣2是__,第二次浸出发生的反应离子方程式是________。
(3)从滤液1、滤液2中分别得到粗ZnSO4·7H2O、粗CuSO4·5H2O的操作均是____、过滤、洗涤、干燥。
(4)某同学在实验完成之后,得到1.5gCuSO4·5H2O(M=250 g·mol–1),则铜的回收率为_____。
【答案】ZnO + H2SO4 = ZnSO4 + H2O, ZnS + H2SO4 = ZnSO4 + H2S↑ SiO2 CuS + 4H2O2 = Cu2+ + SO42– + 4H2O 加热浓缩、冷却结晶 30%
【解析】
废催化剂加入稀硫酸,第一次浸出主要发生反应:ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑、Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O,过滤后滤液中ZnSO4、FeSO4、Fe2(SO4)3,浓缩结晶得到粗ZnSO47H2O,滤渣1含有SiO2、CuS,向盛有滤渣1的反应器中加H2SO4和H2O2溶液,发生氧化还原反应,生成硫酸铜、硫,滤渣2含有硫和二氧化硅,滤液含有硫酸铜,经浓硫酸结晶可得到硫酸铜晶体,据此分析解答。
(1)第一次浸出主要发生的反应化学方程式是ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑,故答案为:ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑;
(2)根据上述分析可知滤渣2含有硫和二氧化硅,第二次浸出时发生反应:CuS+H2O2+H2SO4=CuSO4+S+2H2O,故答案为:SiO2、S;CuS+H2O2+H2SO4=CuSO4+S+2H2O;
(3)从滤液1、滤液2中分别得到粗ZnSO4·7H2O、粗CuSO4·5H2O的操作均为溶液结晶得到含结晶水的晶体,则均采用蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥获得晶体,故答案为:加热浓缩、冷却结晶;
(4)15.0 g该废催化剂中含有12.8%的CuS,其中Cu的物质的量为![]() =0.02mol,1.5g CuSO4﹒5H2O中Cu的物质含量的为
=0.02mol,1.5g CuSO4﹒5H2O中Cu的物质含量的为![]() =0.006mol,则铜的回收率为
=0.006mol,则铜的回收率为![]() ×100%=30%,故答案为:30%。
×100%=30%,故答案为:30%。