题目内容
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E);
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
(3)已知在一定温度下,C(s)+CO2(g)
 2CO(g)平衡常数K;K的表达式 ;
2CO(g)平衡常数K;K的表达式 ;C(s)+H2O(g)
 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;CO(g)+H2O(g)
 H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是: ;
(4)某温度下C(s)+CO2(g)
 2CO(g)能判断该反应达到化学平衡状态的依据是________。
2CO(g)能判断该反应达到化学平衡状态的依据是________。A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(CO)=2v正(CO2) E.c(CO)保持不变 F.混合气体相对分子质量不变
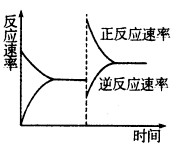
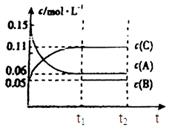
(5)如图1所示,在甲、乙两容器中都充入1molC和1molCO2,并使甲、乙两容器初始容积相等。在相同温度下发生反应C(s)+CO2(g)
 2CO(g),并维持反应过程中温度不变。已知甲容器中
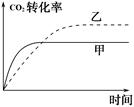
2CO(g),并维持反应过程中温度不变。已知甲容器中CO2的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图像。
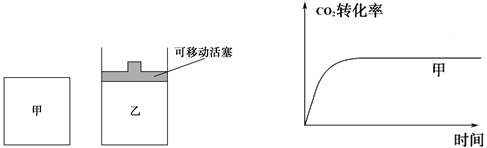
图1 图2
(1)BCE (2) 0.25mol·L-1·s-1
(3)K=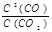 K=K1/K2 (4)CEF
K=K1/K2 (4)CEF
(5)
解析试题分析:(1)先求各个情况下的生成物浓度幂之积与反应浓度幂之积的比:Q(A)=1.2;Q(B)=0.25;Q(D)=1;Q(E)=0.67;可以看出只有BCE向正反应方向移动,而A是逆向移动,D已达到平衡状态。
CO(g)+H2O(g)  H2(g)+CO2(g)
H2(g)+CO2(g)
起始: 10mol 10mol 0 0
变化: x x x x
平衡:(10-x) (10-x) x x
依题意有: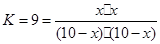
解之得:X=7.5mol
则30s内CO的平均反应速率为: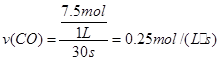
因为碳是固体,因此浓度是定值,在平衡常数表达式中不写出碳。
① C(s)+CO2(g) 2CO(g) 平衡常数K;
2CO(g) 平衡常数K;
② C(s)+H2O(g) CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
③ CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2;
H2(g)+CO2(g) 平衡常数K2;
①就等于②-③,因此平衡常数K=K1/K2
(5)乙相当于甲在相同条件下达到平衡后再减小压强,平衡继续右移,二氧化碳的转化率增大,但是达到平衡的时间会加长,因为压强减小,减慢了反应的速率。
考点:考查化学平衡的有关知识。

金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。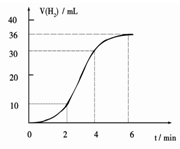
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 | |
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
工业制硫酸的过程中利用反应2SO2(g)+O2(g)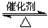 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是 。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为 ,表中y= 。
②T1 T2 ,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为 。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与 c(OH-)之比为 。
②该溶液中c(OH-)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
③当向该溶液中加入少量NaOH固体时,c(SO32-) ,c(Na+) 。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 。
A.Na2CO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+S4O32-+2H2O
①上述离子方程式中x=________;
②每生成1 mol Fe3O4,反应转移的电子为________mol;
(2)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为 。
高炉炼铁过程中发生的主要反应为: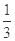 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g) 
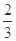 Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(3)该反应的平衡常数表达式K=_ ;Q 0(填“>”、“<”或“=”);
(4)欲提高上述反应中CO的平衡转化率,可采取的措施是 ;
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(5)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正 v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= 。
在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(2)用水稀释0.1 mol·L-1氨水(设稀释时溶液温度不变),则溶液中随着水量的增加而减小的是下列的 (填序号):
A.c(NH3·H2O) B.
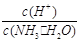 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.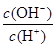
(3)工业用氨制取硝酸的氧化反应为:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
A B C D
(4)在1L容积固定的密闭容器中发生上述反应,部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第4 min | 0.3000 | 0.9750 | 0.5000 |
| 第6 min | 0.3000 | 0.9750 | 0.5000 |
| 第8 min | 0.7000 | 1.475 | 0.1000 |
反应在第6 min到8min时改变了条件,改变的条件可能是___________________;在该条件下,平衡向_______移动(填“左”或“右”)。
请运用化学反应原理的相关知识研究碳及其化合物的性质。
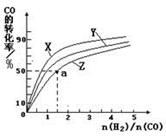
(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________
| A.体系压强保持不变 |
| B.混合气体的密度保持不变 |
| C.CO与H2的浓度之比为1∶2 |
| D.单位时间内,消耗2molH2的同时消耗1mol CH3OH |
(2)已知: CO(g)+
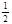 O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+ 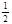 O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1则表示1mol气态甲醇完全燃烧生成CO2和水蒸气的热化学方程式为 __________
 2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为 mol·L-1·min-1。
2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为 mol·L-1·min-1。
 H=-akJ·mol-1
H=-akJ·mol-1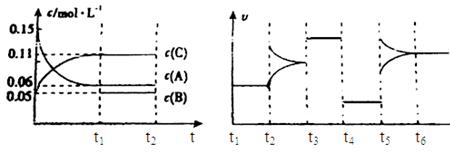
 2SO3(g) △H=-198kJ·mol-1
2SO3(g) △H=-198kJ·mol-1