题目内容
在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(2)用水稀释0.1 mol·L-1氨水(设稀释时溶液温度不变),则溶液中随着水量的增加而减小的是下列的 (填序号):
A.c(NH3·H2O) B.
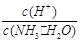 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.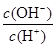
(3)工业用氨制取硝酸的氧化反应为:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):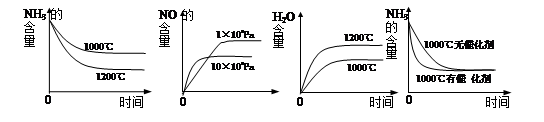
A B C D
(4)在1L容积固定的密闭容器中发生上述反应,部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第4 min | 0.3000 | 0.9750 | 0.5000 |
| 第6 min | 0.3000 | 0.9750 | 0.5000 |
| 第8 min | 0.7000 | 1.475 | 0.1000 |
反应在第6 min到8min时改变了条件,改变的条件可能是___________________;在该条件下,平衡向_______移动(填“左”或“右”)。
(1)(1分) > (2)(2分) AD (3)(2分)BD
(4)(3分)升高温度(或增大压强,2分) 左 (1分)
解析试题分析:(1)从表中可以看出,随着温度的升高,平衡常数越来越大,说明反应正向进行,依据平衡移动原理,可知正向是吸热的方向,也就是说a>0 ;(2)加水稀释,这个平衡中所涉及到的所有的物质的浓度都减小,尽管平衡正向移动,但浓度减小是主要的,移动只是减弱这种改变,但不能消除,因此选AD。 (3)A、升高温度,平衡逆向移动,氨的含量增加,错误;B、正确;C、升高温度,平衡逆向移动,水的含量减小,错误;D、正确。
考点:考查平衡移动原理的应用。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案据报道,在300 ℃、70 MPa 条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。
(1)已知25 ℃、101 kPa条件下,1 g乙醇燃烧生成CO2和液态水时释放出a kJ能量,请写出该条件下乙醇燃烧的热化学反应方程式: 。
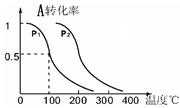
(2)由CO2和H2合成乙醇的化学方程式为2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
①正反应的ΔH 0(填“>”、“<”或“=”);
②该反应的化学平衡常数表达式为K= 。
(3)对于该化学平衡,为了提高H2的转化率,可采取的措施有 。
| A.升温 | B.加压 |
| C.加催化剂 | D.增加CO2的浓度 |
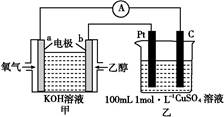
①b电极上发生的电极反应式为 。
②若甲中有0.1 mol CH3CH2OH参加反应,则乙装置中生成的气体在标准状况下的体积共为 L。
金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 | |
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E);
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
(3)已知在一定温度下,C(s)+CO2(g)
 2CO(g)平衡常数K;K的表达式 ;
2CO(g)平衡常数K;K的表达式 ;C(s)+H2O(g)
 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;CO(g)+H2O(g)
 H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是: ;
(4)某温度下C(s)+CO2(g)
 2CO(g)能判断该反应达到化学平衡状态的依据是________。
2CO(g)能判断该反应达到化学平衡状态的依据是________。A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(CO)=2v正(CO2) E.c(CO)保持不变 F.混合气体相对分子质量不变
(5)如图1所示,在甲、乙两容器中都充入1molC和1molCO2,并使甲、乙两容器初始容积相等。在相同温度下发生反应C(s)+CO2(g)
 2CO(g),并维持反应过程中温度不变。已知甲容器中
2CO(g),并维持反应过程中温度不变。已知甲容器中CO2的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图像。
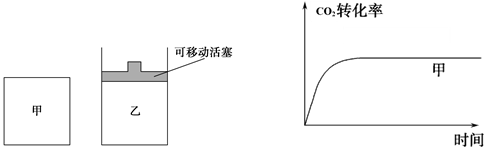
图1 图2
氮气与氢气反应生成氨气的平衡常数见下表:
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
(1)工业上合成氨的温度一般控制在500℃,原因是 。
(2)在2 L密闭容器中加入1 mol氮气和3 mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为________mol/(L·min)。
(3)下列说法能表明该反应达到平衡的是________
A.气体的平均分子量不再变化 B.密闭容器内的压强不再变化
C.v (N2) =" 2" v (NH3) D.气体的密度不再变化
(4)下列措施,既能加快该反应的反应速率,又能增大转化率的是______________
A.使用催化剂 B.缩小容器体积 C.提高反应温度 D.移走NH3
(5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是______。
A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小
(6)将氨水与盐酸等浓度等体积混合,下列做法能使c(NH4+)与c(Cl-)比值变大的是________
A. 加入固体氯化铵 B.通入少量氯化氢
C. 降低溶液温度 D.加入少量固体氢氧化钠
活性炭可处理大气污染物NO。T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
| | 活性炭/mol | NO/mol | A/mol | B/mol |
| 起始状态 | 2.030 | 0.100 | 0 | 0 |
| 2 min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2 min内,用NO表示该反应的平均速率v(NO)=______mol·L-1·min-1。
(2)该反应的化学方程式是______;T℃时,它的平衡常数K=9/16,则2 min时反应______(填“是”或“不是”)平衡状态;已知升高温度时,K增大,则该反应为______(填“吸热”或“放热”)反应。
(3)为了提高反应速率和NO的转化率,可采取的措施是______。
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为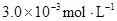 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA  | 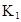 | 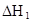 | 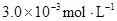 |
在苯中,2HA 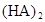 | 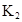 | 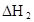 | 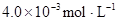 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则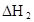 ___________0。
___________0。(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足
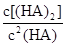 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。 如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
(1)若固定隔板K,能表示甲容器中一定达到化学平衡的是
| A.甲中气体的总压强不变 | B.各气体的物质的量浓度不变 |
| C.混合气体的平均摩尔质量不变 | D.混合气体的密度不变 |
(2)达到平衡后隔板K是否可能处于0刻度 ________(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(3)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为________mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度______处(填下列序号:①<6 ②>6 ③=6)。
(4)若一开始就将K、F固定,其他条件均不变,甲平衡后压强变为开始压强的0.8倍,则甲、乙都达到平衡后,两容器的压强之比为P甲:P乙=
 C(g)
C(g)