��Ŀ����
�����û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1����ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����ں��������У��÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO(g)��2H2(g)  CH3OH(g)����H1����116 kJ��mol��1
CH3OH(g)����H1����116 kJ��mol��1
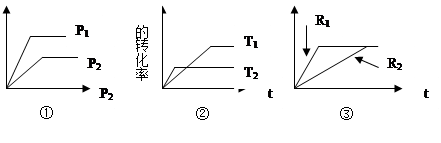
�����д�ʩ����˵����Ӧ�ﵽƽ��״̬����___________
| A����ϵѹǿ���ֲ��� |
| B�����������ܶȱ��ֲ��� |
| C��CO��H2��Ũ��֮��Ϊ1��2 |
| D����λʱ���ڣ�����2molH2��ͬʱ����1mol CH3OH |
��2����֪�� CO(g)+
 O2(g)=CO2(g) ��H2����283 kJ��mol-1 H2(g)+
O2(g)=CO2(g) ��H2����283 kJ��mol-1 H2(g)+  O2(g)=H2O(g) ��H3����242 kJ��mol-1
O2(g)=H2O(g) ��H3����242 kJ��mol-1���ʾ1mol��̬�״���ȫȼ������CO2��ˮ�������Ȼ�ѧ����ʽΪ��__________
��1����AD��2�֣�©ѡ��1�֣���ѡ��0�֣�
��270�棨2�֣���λ��λ����1�֣���
��2��CH3OH(g)��3/2O2(g) CO2(g)��2H2O(g) ��H����651kJ��mol��1 ��2�֣�
CO2(g)��2H2O(g) ��H����651kJ��mol��1 ��2�֣�
���������������1����Aѡ����Ӧǰ��������������ı䣬ѹǿ���䣬����˵������ƽ�⡣Dѡ������V��=V������ΪZͼ����CO��ת������ͣ����Զ�Ӧ���¶���ߡ�270�� ������ͼ���֪a���Ӧ��CO��ת����Ϊ50%��H2�����ʵ���Ϊ1.5 mol
CO��g�� +���� 2H2(g)�� �� CH3OH(g)
�� CH3OH(g)
��ʼ���ʵ���Ũ��(mol/L)�� 1��������������1.5������������ 0��������
ת�����ʵ���Ũ��(mol/L)��0.5��������������1������������ 0.5
ƽ�����ʵ���Ũ��(mol/L)��0.5��������������0.5������������0.5������
K=4
��2�����ø�˹���ɿ���д��CH3OH(g)��3/2O2(g) CO2(g)��2H2O(g) ��H=����H1+��H2+2��H3
CO2(g)��2H2O(g) ��H=����H1+��H2+2��H3
���㣺��ѧƽ����жϺͻ�ѧƽ��ļ��㡣

ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ���ֵ�����⡣
��֪��CO��g��+H2O��g��  H2��g��+CO2��g��ƽ�ⳣ�����¶ȵı仯���±���
H2��g��+CO2��g��ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
��1����800�淢��������Ӧ���Ա��е����ʵ���Ͷ����ݷ�Ӧ��������������Ӧ�����ƶ����� ��ѡ��A��B��C��D��E����
| | n��CO�� | n��H2O�� | n��H2�� | n��CO2�� |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
��3����֪��һ���¶��£�C��s��+CO2��g��
 2CO��g��ƽ�ⳣ��K��K�ı���ʽ ��
2CO��g��ƽ�ⳣ��K��K�ı���ʽ ��C��s��+H2O��g��
 CO��g��+H2��g�� ƽ�ⳣ��K1��
CO��g��+H2��g�� ƽ�ⳣ��K1��CO��g��+H2O��g��
 H2��g��+CO2��g��ƽ�ⳣ��K2��
H2��g��+CO2��g��ƽ�ⳣ��K2����K��K1��K2֮��Ĺ�ϵ�ǣ� ������ ��
��4��ij�¶���C��s��+CO2��g��
 2CO��g�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________��
2CO��g�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________��A.c(CO2)��c(CO) B.K���� C.�����е�ѹǿ����
D.v��(CO)��2v��(CO2) E.c(CO)���ֲ��� F.���������Է�����������
��5����ͼ1��ʾ���ڼס����������ж�����1molC��1molCO2����ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·�����ӦC��s��+CO2��g��
 2CO��g������ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������
2CO��g������ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������CO2��ת������ʱ��仯��ͼ����ͼ2��ʾ������ͼ2�л�����������CO2��ת������ʱ��仯��ͼ��
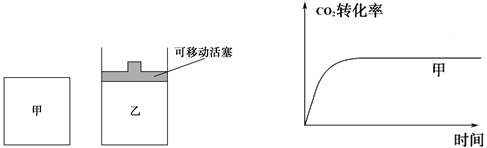
ͼ1 ͼ2
��ͼ��ʾ���ס���֮��ĸ���K�ͻ���F���������ƶ������г���2 mol SO2��1 mol O2�����г���2 mol SO3��1 mol He����ʱKͣ��0������һ�������·������淴Ӧ��2SO2(g)��O2(g) 2SO3(g)����Ӧ�ﵽƽ����ٻָ���ԭ�¶ȣ��ش��������⣺
2SO3(g)����Ӧ�ﵽƽ����ٻָ���ԭ�¶ȣ��ش��������⣺
��1�����̶�����K���ܱ�ʾ��������һ���ﵽ��ѧƽ�����
| A�������������ѹǿ���� | B������������ʵ���Ũ�Ȳ��� |
| C����������ƽ��Ħ���������� | D�����������ܶȲ��� |
��2���ﵽƽ������K�Ƿ���ܴ���0�̶� ________(����ܡ������ܡ�)����K����ͣ����0�̶����a������aһ��С��________��
��3����ƽ��ʱ��K����ͣ�������̶�1���������SO3�����ʵ���Ϊ________mol������SO3��ת����________50%(�>������<������)������F����ͣ�����Ҳ�̶�______��(��������ţ���<6����>6���ۣ�6)��
��4����һ��ʼ�ͽ�K��F�̶����������������䣬��ƽ���ѹǿ��Ϊ��ʼѹǿ��0.8������ס��Ҷ��ﵽƽ�����������ѹǿ֮��ΪP����P��=
��һ��������ܱ������У��������»�ѧ��Ӧ��
Fe2O3(s)��3CO(g)  2Fe(s)��3CO2(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2Fe(s)��3CO2(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t�� | 1000 | 1150 | 1300 |
| K | 64.0 | 50.7 | 42.9 |
��ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK�� ��
��2���÷�ӦΪ ��Ӧ������ȡ����ȡ�����
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬�������� ����ѡ��,��ѡ���÷֣���
a��������ѹǿ���� b����������� c��CO������
c��������CO����������CO2�� d��c��CO2����c��CO��
��4����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⡣���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ����
��(CO)�� ��CO��ƽ��ת����Ϊ�� ��
Ϊ������Ⱦ������úת��Ϊ�������ȼ�ϣ��ɽ���̿��ˮ������Ӧת��Ϊ������һ����̼��C(s)+ H2O(g)  H2(g)+ CO(g)
H2(g)+ CO(g)  H>0�������ݻ��̶�Ϊ2L�ܱ������У�����2mol C(s)��2mol H2O(g)����T���³�ַ�Ӧ������Ӻ�ﵽƽ�⣬���H2Ϊ0.75mol��
H>0�������ݻ��̶�Ϊ2L�ܱ������У�����2mol C(s)��2mol H2O(g)����T���³�ַ�Ӧ������Ӻ�ﵽƽ�⣬���H2Ϊ0.75mol��
��1����H2O(g)��ʾ��Ӧ��ʼ���ﵽƽ���ƽ������ ��
��2������T���¸÷�Ӧ��ƽ�ⳣ��K= �����¶����ߣ���Ӧƽ�ⳣ���� ���������С�����䡱����
��3�����������¸÷�Ӧ�ﵽƽ��״̬������˵����ȷ����
| A����С���������ƽ�������ƶ� | B�����������CO�IJ������� |
| C������̼������H2O(g)��ת�������� | D�������¶ȣ�H2O(g)��ת���ʽ��� |
��һ��������ܱ������У��������·�Ӧ��A��g�� B��g��+C��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
| toC | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ��ѧƽ�ⳣ���ı���ʽ��K= ��
��2������ͼ����ʵ�����÷�Ӧ�������仯���ߣ�ͬʱ�ڴ˻����������������������������仯���ߡ�

��3��һ���¶Ⱥ�����£�����˵������˵���÷�Ӧ��ƽ��״̬���� ��
��������ѹǿ����
�ڻ��������c��C������
�ۻ��������ܶȲ���
��v��A��=v��B��
�ݻ�ѧƽ�ⳣ��K����
�������ƽ��ʽ������
��4����Ӧʱ�䣨t��������������A��Ũ�����ݼ��±�
| ʱ��t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 |
| C��A��/��mol��L��1�� | 10.4 | 8.6 | 7.5 | 6.6 | 5.9 | 5.5 | 5.5 |
�ش��������⣺
��2��4min�ڣ�B��ƽ������Ϊ ��
�ڷ�Ӧ��ƽ��ʱ��A��ת����Ϊ ��
�������A��ƽ��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��
 CH3OH ( g ) ��H=-116kJ/mol
CH3OH ( g ) ��H=-116kJ/mol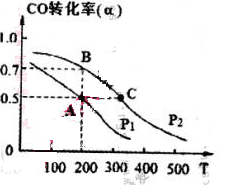
 C(g)
C(g) 
 xC��g�� ��H ��:
xC��g�� ��H ��: