题目内容
5.下列说法正确的是( )| A. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C是碳元素的三种核素 | |
| B. | SO2分子中含有离子键 | |
| C. | MgCl2固体中含有共价键 | |
| D. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O含有相同的中子数 |
分析 A.质子数相同、中子数不同的同一元素不同元素互称同位素,同位素属于不同的核素;
B.非金属元素之间易形成共价键;
C.活泼金属和活泼非金属元素之间易形成离子键;
D.中子数=质量数-质子数.
解答 解:A.质子数相同、中子数不同的同一元素不同元素互称同位素,同位素属于不同的核素,${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C的质子数相同、中子数不同,是碳元素的三种核素,故A正确;
B.非金属元素之间易形成共价键,二氧化硫中只含共价键,故B错误;
C.活泼金属和活泼非金属元素之间易形成离子键,氯化镁中只含离子键,故C错误;
D.中子数=质量数-质子数,${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O的中子数分别是8、9、10,所以中子数不同,故D错误;
故选A.
点评 本题考查化学键、核素等知识,侧重考查基本概念,明确离子键和共价键的区别是解本题关键,知道质子数、中子数和质量数的体系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.某同学利用铁与水蒸气反应后的固体物质进行了如下实验:
固体$\stackrel{稀盐酸}{→}$淡黄色溶液$\stackrel{试剂1}{→}$淡红色溶液$\stackrel{新制氯水}{→}$淡红色溶液$→_{时间后}^{一般}$溶液褪色
(1)固体溶于稀盐酸的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)试剂1的化学式是KSCN;加入试剂1后呈红色的原因是(用离子方程式表示):Fe3++3SCN-=Fe(SCN)3.
(3)加入新制氯水后溶液红色加深的原因是(用化学用语和必要文字解释)2Fe2++Cl2=2Fe3++2Cl-
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?(提示:SCN-中硫元素化合价为-2价)
为验证丁同学的猜想合理与否?请同学们根据结论完成下表的实验设计方案.可选用试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、0.1mol•L-1FeCl3、0.1mol•L-1CuSO4、20%KSCN、蒸馏水.
固体$\stackrel{稀盐酸}{→}$淡黄色溶液$\stackrel{试剂1}{→}$淡红色溶液$\stackrel{新制氯水}{→}$淡红色溶液$→_{时间后}^{一般}$溶液褪色
(1)固体溶于稀盐酸的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)试剂1的化学式是KSCN;加入试剂1后呈红色的原因是(用离子方程式表示):Fe3++3SCN-=Fe(SCN)3.
(3)加入新制氯水后溶液红色加深的原因是(用化学用语和必要文字解释)2Fe2++Cl2=2Fe3++2Cl-
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?(提示:SCN-中硫元素化合价为-2价)
| 编 号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的+3价Fe被氧化为更高的价态 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 丁 | ? |
| 实验操作 | 预期现象 | 结 论 |
| 说明丁同学的猜想是合理的 |
16.按反应特征与产物的结构关系,有机反应大致可分为:取代反应、消去反应、加成反应三种,下列变化中不属于取代反应的是( )
| A. | C6H5CH2Cl+NaCN-→C6H5CH2CN+NaCl | B. | 2Na+2 C2H5OH-→2C2H5ONa+H2↑ | ||
| C. | CH3CH2CHO+HCN-→CH3CH2CH(CN)OH | D. | CH3COOC2H5+H2O-→CH3COOH+C2H5OH |
13.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 化学反应一定有新物质的生成,但不一定有能量的变化 |
10.下列有关元素的性质及其递变规律正确的是( )
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | ⅠA和ⅦA族元素间可形成离子化合物和共价化合物 | |
| C. | 同主族元素的简单阴离子还原性越强,元素非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其金属性越强 |
17.硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等.利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如图1:
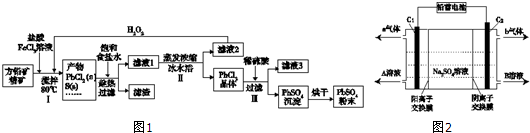
已知:(ⅰ)PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
(ⅱ)有关物质的Ksp和沉淀时的pH如下:
(1)步骤Ⅰ中生成PbCl2的离子方程式PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓,加入盐酸控制pH值小于2,原因是抑制Fe3+、Pb2+的水解,防止生成Fe(OH)3、Pb(OH)2沉淀.
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出.若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是Fe3+水解生成Fe(OH)3胶体,吸附溶液中悬浮杂质,被共同沉淀.
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)=PbSO4(s)+2Cl-(aq).
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为PbSO4+2e-=Pb+SO42-.
(6)双隔膜电解池的结构示意简图如图2所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是AD
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑

已知:(ⅰ)PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
| Ksp | 开始沉淀时pH | 完全沉淀时pH | ||
| PbSO4 | 1.08×10-8 | Fe (OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Pb( OH)2 | 6 | 7.04 |
(1)步骤Ⅰ中生成PbCl2的离子方程式PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓,加入盐酸控制pH值小于2,原因是抑制Fe3+、Pb2+的水解,防止生成Fe(OH)3、Pb(OH)2沉淀.
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出.若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是Fe3+水解生成Fe(OH)3胶体,吸附溶液中悬浮杂质,被共同沉淀.
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)=PbSO4(s)+2Cl-(aq).
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为PbSO4+2e-=Pb+SO42-.
(6)双隔膜电解池的结构示意简图如图2所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是AD
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑
14.下列关于苯酚的叙述中,错误的是( )
| A. | 其水溶液显弱酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 苯酚溶液不能使酸性高锰酸钾溶液褪色 |
15.依据物质的相关数据,可以推断物质的结构和性质.下列推断不合理的是( )
| A. | 依据原子序数,推断该元素原子的核外电子数 | |
| B. | 依据相对分子质量,推断物质常温下的溶解度 | |
| C. | 依据气体的摩尔质量,推断相同状况下不同气体密度的大小 | |
| D. | 依据元素原子的最外层电子数,推测其可能的最高正价和最低化合价 |