题目内容
8.下表为元素周期表的一部分,请回答有关问题: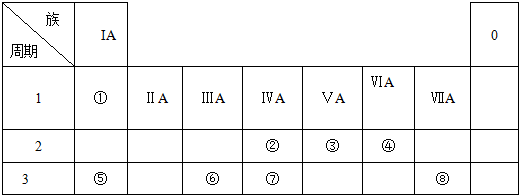
(1)①的元素名称是氢.
(2)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.(填元素符号)
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.(填对应的酸)
(4)④、⑤两种元素可形成既含有离子键又含有非极性共价键的化合物,写出化合物的电子式
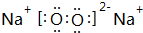 .
.
分析 由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)①为氢元素;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)由于同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强;
(4))④、⑤两种元素可形成既含有离子键又含有非极性共价键的化合物为Na2O2.
解答 解:由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)由元素位置可知,①为氢元素,故答案为:氢;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(3)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(4))④、⑤两种元素可形成既含有离子键又含有非极性共价键的化合物为Na2O2,其电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表与元素周期律的综合应用,难度不大,侧重学生对基础知识的巩固.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
3.25℃时,pH=12的Ba(OH)2溶液中,由水电离出的OH-浓度是( )
| A. | 2×10-2mol•L-1 | B. | 1×10-12mol•L-1 | C. | 1×10-2mol•L-1 | D. | 2×10-12mol•L-1. |
13.下列分子构型呈正四面体结构的是( )
①P4 ②NH3 ③CCl4 ④金刚石 ⑤CH4 ⑥SiO2 ⑦H2O ⑧CO2.
①P4 ②NH3 ③CCl4 ④金刚石 ⑤CH4 ⑥SiO2 ⑦H2O ⑧CO2.
| A. | ①③④⑤ | B. | ①③④⑤⑥ | C. | ①③⑤ | D. | ④⑤ |
20.下列某化合物在分类中同时符合图示要求的是( )


| A. | Na2CO3 | B. | NaHCO3 | C. | CaCO3 | D. | Cu2(OH)2CO3 |
17.由配位键形成的[Ag(NH3)2]OH中,中心离子银的化合价是( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |


 ;
;