题目内容
9.用NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 5.6g金属铁与足量稀盐酸反应完全反应时,失去0.3NA个电子 | |
| B. | 20g重水(2H2O)含有10NA个电子 | |
| C. | 0.1mol/L的氯化铝溶液500mL,氯离子的物质的量浓度为0.15 mol/L | |
| D. | 在常温常压下,11.2 L氮气所含的原子数目为NA |
分析 A、求出铁的物质的量,然后根据铁与盐酸反应后变为+2价来分析;
B、重水的摩尔质量为20g/mol;
C、AlCl3中含3个氯离子;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、5.6g铁的物质的量为0.1mol,而铁与盐酸反应后变为+2价,故0.1mol铁失去0.2mol电子即0.2NA个,故A错误;
B、重水的摩尔质量为20g/mol,故20g重水的物质的量为1mol,而重水中含10个电子,故1mol重水中含10NA个电子,故B正确;
C、AlCl3中含3个氯离子,故0.1mol氯化铝溶液中含有的氯离子的物质的量浓度为0.3mol/L,与其溶液体积无关,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则含有的原子数目小于NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.下列装置、操作及说法正确的是( )
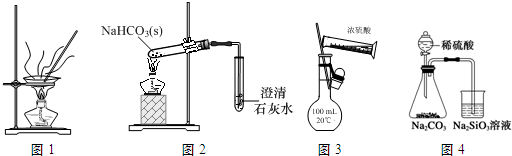

| A. | 用图1装置灼烧CuSO4•5H2O晶体除去结晶水 | |
| B. | 用图2装置探究NaHCO3的热稳定性 | |
| C. | 用图3装置配制100 mL 0.1 mol•L-1的硫酸 | |
| D. | 用图4装置比较硫、碳、硅三种元素的非金属性强弱 |
20.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 0.1molFe在0.1mol氯气中充分燃烧时转移的电子数为0.3NA | |
| B. | 0.1mol乙烷和丙烯的混合物所含氢原子数目为0.6NA | |
| C. | 64g的SO2与足量的O2充分反应后可得到NA个S03分子 | |
| D. | 标准状况下,2.24L HF含有的分子数目为0.1NA |
17.下列关于化学键的叙述中正确的是( )
| A. | 化学键存在于原子之间,也存在于分子之间 | |
| B. | 两个原子之间的相互作用叫做化学键 | |
| C. | 离子键是阴、阳离子之间的相互吸引力 | |
| D. | 化学键通常是指相邻的两个或多个原子之间强烈的相互作用 |
4.在1.01×105Pa,150℃条件下,某烃完全燃烧,反应前后压强(体积)不变,该有机物可能是( )
| A. | C2H6 | B. | C6H6 | C. | C2H4 | D. | C2H2 |
14.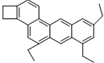 如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”,有关doggycene的说法正确的是 ( )
如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”,有关doggycene的说法正确的是 ( )
 如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”,有关doggycene的说法正确的是 ( )
如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”,有关doggycene的说法正确的是 ( )| A. | 该分子中所有碳原子可能处于同一平面 | |
| B. | doggycene的分子式为:C26H30 | |
| C. | 1mol该物质在氧气中完全燃烧生成CO2和水的物质的量之比为1:1 | |
| D. | 该物质常温为气态. |
1.有pH值都等于4的硝酸和醋酸,均取1mL加水稀释至amL和bmL,测得稀释后溶液的pH均为5,则稀释后溶液的体积( )
| A. | a=b=100mL | B. | a=b=1000mL | C. | a<b | D. | a>b |
19.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )
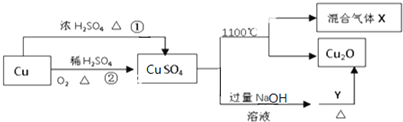

| A. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| B. | Y可以是葡萄糖溶液 | |
| C. | 相对于途径①,途径②更好地体现了绿色化学思想 | |
| D. | 将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |