题目内容
1.有pH值都等于4的硝酸和醋酸,均取1mL加水稀释至amL和bmL,测得稀释后溶液的pH均为5,则稀释后溶液的体积( )| A. | a=b=100mL | B. | a=b=1000mL | C. | a<b | D. | a>b |
分析 醋酸是弱电解质、硝酸是强电解质,pH相等的醋酸和硝酸,醋酸浓度大于硝酸,加水稀释促进醋酸电离,导致稀释相同倍数的溶液中醋酸中氢离子浓度大于硝酸,据此来分析当稀释后溶液的pH均为5时,稀释后溶液的体积.
解答 解:醋酸是弱电解质、硝酸是强电解质,pH相等的醋酸和硝酸,醋酸浓度大于硝酸,加水稀释促进醋酸电离,导致稀释相同倍数的溶液中醋酸中氢离子浓度大于硝酸,要使稀释后溶液中pH相等,则醋酸需要水体积大于硝酸;而要使pH=4的硝酸稀释后溶液pH=5,根据氢离子浓度相等,知硝酸要稀释10倍,则硝酸稀释后溶液体积为10mL,则稀释后a>b=10mL,故选D.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,同时考查学生逆向思维能力,题目难度不大.

练习册系列答案
相关题目
11.如图为KNO3、NaCl的溶解度曲线图,下列有关说法正确的是( )


| A. | 温度相同(>t1℃)时,KNO3溶液中溶质的质量分数大于NaCl溶液中溶质的质量分数 | |
| B. | t1℃时,KNO3、NaCl饱和溶液中溶质的物质的量浓度相等 | |
| C. | 用“溶解→蒸发→趁热过滤”方法可提纯含有少量KNO3杂质的NaCl固体 | |
| D. | 将50g KNO3饱和溶液从t2℃降至t1℃,析出固体质量小于0.5(b-a)g |
9.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 5.6g金属铁与足量稀盐酸反应完全反应时,失去0.3NA个电子 | |
| B. | 20g重水(2H2O)含有10NA个电子 | |
| C. | 0.1mol/L的氯化铝溶液500mL,氯离子的物质的量浓度为0.15 mol/L | |
| D. | 在常温常压下,11.2 L氮气所含的原子数目为NA |
16.下列物质互为同位素的是( )
| A. | H2和D2 | B. | 金刚石和石墨 | ||
| C. | CO和CO2 | D. | ${\;}_{17}^{37}$Cl和${\;}_{17}^{35}$Cl |
13.理论上不能用设计成原电池的反应是( )
| A. | CaO+H2O═Ca(OH)2△H<0 | B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | ||
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4 Fe(OH)3(s)△H<0 | D. | 2H2(g)+O2(g)═2H2O(l)△H<0 |
10.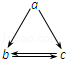 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al2O3 | AlCl3 | Al(OH)3 |
| B | FeO | FeCl2 | Fe(OH)3 |
| C | Si | SiO2 | H2SiO3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
11.下列物质中,由原子直接构成的是( )
| A. | 金刚石 | B. | 氯化钠 | C. | 氧气 | D. | 水 |
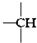 、
、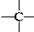 ,其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
,其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论: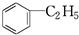 ②CH3CH3③CH2═CHCH═CH2④
②CH3CH3③CH2═CHCH═CH2④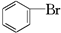 ⑤
⑤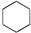 ⑥CH≡CH
⑥CH≡CH