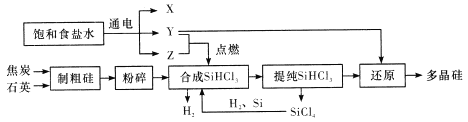
题目内容
【题目】科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对氢能源的研究获得了迅速发展。
(1)已知1 mol H2完全燃烧时放出285.8 kJ的热量,试写出H2燃烧的热化学方程式:_________。
(2)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是_________(填序号)。
A.电解水 B.锌和稀硫酸反应 C.光解海水
(3)某学生查阅大量资料,提出下列用水制取氢气的研究方向:
①研究在水不发生化学反应的情况下制取氢气,同时释放能量。
②设法将太阳光聚焦,产生高温,使水分解产生氢气。
③寻找高效催化剂,提高水在一定条件下分解产生氢气的转化率。
④寻找特殊化学物质,用于开发廉价能源,用以分解水制取氢气
请你从上述研究方向中,选择其中不合理的项,并简述理由:不合理的是_________,理由是___________。
【答案】H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ/mol C ①③ ①:水分子中不含氢气分子,不可能在不发生化学反应的情况下得到氢气,且水分解是吸热反应(或③:催化剂能提高水分解产生氢气的反应速率,但不能提高水的转化率)
O2(g)=H2O(l) △H=-285.8 kJ/mol C ①③ ①:水分子中不含氢气分子,不可能在不发生化学反应的情况下得到氢气,且水分解是吸热反应(或③:催化剂能提高水分解产生氢气的反应速率,但不能提高水的转化率)
【解析】
(1)书写热化学方程式时反应热要与反应的物质相对应,且要注明物质的聚集状态,据此书写热化学方程式;
(2)从开发较经济且资源可持续利用的制取氢气的方法要从能源消耗分析;
(3)①根据物质的分类、含有的元素、能量转化、物理变化与化学变化概念特点分析;
②用水制取新能源氢气,需吸收能量,设法将太阳光聚焦,产生高温使水分解产生氢气;
③根据概念及在反应中催化剂的作用分析;
④寻找特殊的化学物质,改变水分解的化学反应速率,用于开发廉价能源,以分解水制取氢气。
(1)1 mol H2完全燃烧产生1 mol液态H2O时放出285.8 kJ的热量,则其燃烧的热化学方程式为H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ/mol;
O2(g)=H2O(l) △H=-285.8 kJ/mol;
(2)A. 电解水需要大量的电能,不符合廉价的要求,A不符合题意;
B. 锌与稀硫酸反应,需要消耗大量的锌和硫酸,不符合廉价的要求,B不符合题意;
C. 光解海水,可充分利用光能,廉价而又低碳,符合要求,C符合题意;
故合理选项是C;
(3)①水是纯净物,不是混合物,水是化合物,其中含有H、O两种元素,而H2是单质,因此由水制取氢气的变化是由化合物转化为单质,发生的是化学变化,且水分解反应是吸热反应,故①不可行;
②用水制取新能源氢气,水在高温下也可以发生分解反应,设法将太阳光聚焦,产生高温使水分解产生氢气,②可行;
③催化剂,能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有发生改变,故寻找高效催化剂,使水分解产生氢气的速率加快,但催化剂不能使化学平衡发生移动,因此不能改变水分解的转化率,③不可行;
④寻找特殊的化学物质,改变水分解的化学反应速率,用于开发廉价能源,以分解水制取氢气,④可行;
综上所述可知:不可行的措施是①③。