题目内容
【题目】用2-溴丙烷制取1,2-丙二醇[(CH3CH(OH)CH2OH)]经过三步。请写出相应的化学方程式,注明反应类型。
(1)___________ 反应类型 ___________
(2)__________ 反应类型 ___________
(3)_________ 反应类型 ____________
【答案】CH3CHBrCH3+NaOH![]() CH3CH=CH2 ↑ +NaBr+ H2O 消去反应 CH2= CHCH3+ Br2→ CH2Br —CHBrCH3 加成反应 CH3CHBrCH2Br+ 2NaOH
CH3CH=CH2 ↑ +NaBr+ H2O 消去反应 CH2= CHCH3+ Br2→ CH2Br —CHBrCH3 加成反应 CH3CHBrCH2Br+ 2NaOH![]() CH3CH(OH)CH2OH+2NaBr 水解反应或取代反应
CH3CH(OH)CH2OH+2NaBr 水解反应或取代反应
【解析】
用2-溴丙烷制取1,2-丙二醇[(CH3CH(OH)CH2OH)],2-溴丙烷发生消去反应,得到的产物再发生加成,加成产物再发生水解。
⑴2-溴丙烷发生消去反应生成丙烯,反应方程式为CH3CHBrCH3+NaOH![]() CH3CH=CH2 ↑ +NaBr+ H2O;故答案为:CH3CHBrCH3+NaOH
CH3CH=CH2 ↑ +NaBr+ H2O;故答案为:CH3CHBrCH3+NaOH![]() CH3CH=CH2 ↑ +NaBr+ H2O;消去反应。
CH3CH=CH2 ↑ +NaBr+ H2O;消去反应。
⑵丙烯与溴单质发生加成反应生成CH2Br—CHBrCH3,反应方程式为CH2= CHCH3+ Br2→ CH2Br—CHBrCH3;故答案为:CH2= CHCH3+ Br2→ CH2Br—CHBrCH3;加成反应。
⑶CH2Br—CHBrCH3发生水解反应(取代反应)生成CH3CH(OH)CH2OH,反应方程式为CH3CHBrCH2Br+ 2NaOH![]() CH3CH(OH)CH2OH+2NaBr;故答案为:CH3CHBrCH2Br+ 2NaOH
CH3CH(OH)CH2OH+2NaBr;故答案为:CH3CHBrCH2Br+ 2NaOH![]() CH3CH(OH)CH2OH+2NaBr;水解反应或取代反应。
CH3CH(OH)CH2OH+2NaBr;水解反应或取代反应。

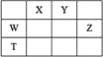
【题目】已知反应![]() ,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,![]()
C.6min时,容器中剩余1.4molY
D.其他条件不变,将X的物质的量改为10mol,则可得到4molZ
【题目】对下列实验事实的解释正确的是( )
现象 | 解释或结论 | |
A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
C | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
A.AB.BC.CD.D
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
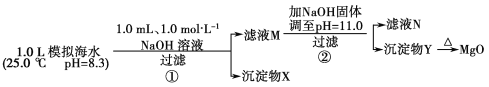
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物