题目内容
【题目】将![]() 与
与![]() 混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
混合在一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
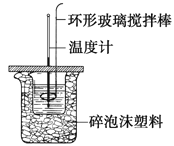
(1)实验中玻璃棒的作用______。
(2)写出有关反应的化学方程式:______。
(3)实验中观察到的现象有______,能闻到刺激性气味,反应混合物成糊状。
(4)实验中的现象说明该反应为______ (填“吸热”或“放热”)反应。用NaOH溶液检验铵根离子时,反应一般需要加热,而该反应在常温下能够发生,原因是______。
【答案】搅拌,使混合物充分接触并反应 ![]() 玻璃片上的水结冰而与小烧杯粘在一起 吸热 吸收外部环境(空气)中的热量
玻璃片上的水结冰而与小烧杯粘在一起 吸热 吸收外部环境(空气)中的热量
【解析】
![]() 与
与![]() 混合发生反应:
混合发生反应:![]() ,该反应为吸热反应。
,该反应为吸热反应。
(1)实验中用玻璃棒迅速搅拌,其作用为搅拌,使混合物充分接触并反应。
(2)发生反应:![]() 。
。
(3)因反应为吸热反应,使容器温度降低,故可观察到玻璃片上的水结冰而与小烧杯粘在一起。
(4)通过现象推知,反应为吸热反应,吸收外部环境(空气)中的热量,因此该反应在常温下能够发生。

 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】对下列实验事实的解释正确的是( )
现象 | 解释或结论 | |
A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
C | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
A.AB.BC.CD.D
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
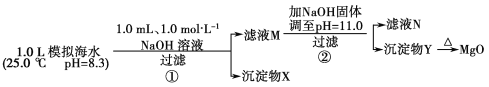
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X在元素周期表中的位置为:___,它的一种核素可测定文物年代,这种核素的符号是___。
(2)元素Y的原子结构示意图为___,Y与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法__。
(3)元素Z与元素T相比,非金属性较强的是__(用元素符号表示),下列表述中能证明这一事实的是___(填字母)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)X的最高价氧化物的结构式为__。