题目内容
14. 往一体积不变的密闭容器中充入A2和B2,发生反应A2(g)+B2(g)?2C(g)△H>0;当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大.下列说法正确的是( )
往一体积不变的密闭容器中充入A2和B2,发生反应A2(g)+B2(g)?2C(g)△H>0;当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大.下列说法正确的是( )| A. | 平衡向逆反应方向移动,平均相对分子质量不变 | |
| B. | 平衡向正反应方向移动,混合气体密度增大 | |
| C. | A2转化率增大,C平衡浓度变大 | |
| D. | t0时降低体系温度 |
分析 由图可知,t0时改变反应的某一条件,正逆反应速率都增大,且正反应速率大于逆反应速率,则平衡向正反应方向移动,该反应前后气体计量数不变,△H>0,则只能是通过升高温度来实现,以此来解答.
解答 解:A.均为气体,质量不变,化学计量数之和反应前后相等,气体的总物质的量不变,则平均相对分子质量不变,但正反应速率大于逆反应速率,则平衡向正反应方向移动,故A错误;
B.体积不变的密闭容器,质量、体积均不变,则密度不变,故B错误;
C.该反应前后气体计量数不变,△H>0,则只能是通过升高温度来实现,则升高温度,平衡向正反应方向移动,A2转化率增大,C平衡浓度变大,故C正确;
D.由选项C可知,t0时升高体系温度,故D错误;
故选C.
点评 本题考查反应速率及化学平衡的影响因素,为高频考点,把握反应速率、平衡移动与温度、压强的关系为解答的关键,侧重分析与应用能力的考查,注意图中正逆反应与平衡移动的关系,题目难度不大.

练习册系列答案
相关题目
2.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 4g重水(D2O)中所含质子数为0.2×6.02×1023 | |
| B. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2×6.02×1023 | |
| C. | 4.48LH2和O2的混合气体中所含分子数为0.2×6.02×1023 | |
| D. | 0.2molCl2溶解于等体积的水中,转移电子数为0.2×6.02×1023 |
9.研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )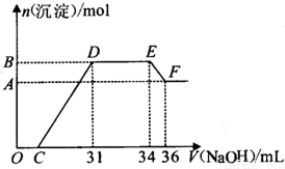

| A. | OC段离子反应方程式为H++OH-═H2O | |
| B. | 溶液中n(NH${\;}_{4}^{+}$)=0.012 mol | |
| C. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ | |
| D. | 欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量 |
19.减少酸雨的产生可采用的措施是 ( )
①少用煤做燃料
②燃料脱硫
③把工厂烟囱造高
④开发新能源
⑤在已酸化的土壤中加石灰.
①少用煤做燃料
②燃料脱硫
③把工厂烟囱造高
④开发新能源
⑤在已酸化的土壤中加石灰.
| A. | ①②⑤ | B. | ①②④ | C. | ①③④⑤ | D. | ②③④⑤ |
3.下列叙述正确的是( )
| A. | 常温常压下,1molCO2的体积是22.4L | |
| B. | 标准状况下1molH2O的体积为22.4L | |
| C. | 标准状况下2molO2的体积约为44.8L | |
| D. | 1molO2和1molN2的体积相等 |
4.下列叙述不正确的是( )
| A. | 标况下,混合气体的平均分子量可表示为22.4•混合气体的平均密度 | |
| B. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| C. | 1.0L1mol/L的NaOH溶液中所含氧原子数为1NA | |
| D. | 常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
 在溴乙烷与NaOH乙醇溶液的反应中有气体生成.有人设计了如图实验方案,检验生成的气体是否是乙烯.请按照要求填空:
在溴乙烷与NaOH乙醇溶液的反应中有气体生成.有人设计了如图实验方案,检验生成的气体是否是乙烯.请按照要求填空: