题目内容
9.随着卤族元素原子序数递增,下列说法正确的是( )| A. | 单质的熔、沸点逐渐降低 | |
| B. | 最高价氧化物对应水化物酸性逐渐减弱 | |
| C. | 单质的氧化性逐渐增强 | |
| D. | 气态氢化物的稳定性逐渐增强 |
分析 卤族元素从上到下,随着原子序数的增大,原子半径逐渐增大,元素的非金属性逐渐减弱,对应单质的氧化性逐渐减弱,最高价氧化物对应水化物酸性逐渐减弱,气态氢化物的稳定性减弱.
解答 解:A:卤素单质都属于分子晶体,从上到下单质的相对分子质量逐渐增大,分子间作用力逐渐增强,单质的沸点升高,故A错误;
B、卤族元素从上到下,元素的非金属性逐渐减弱,最高价氧化物对应水化物酸性逐渐减弱,故B正确;
C、卤族元素从上到下,元素的非金属性逐渐减弱,对应单质的氧化性逐渐减弱,故C错误;
D、卤族元素从上到下,元素的非金属性逐渐减弱,气态氢化物的稳定性减弱,故D错误;
故选:B.
点评 本题考查同主族元素对应单质、化合物的性质的递变,题目难度不大,注意元素周期律的递变规律,注意把握卤素原子的结构及其性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列说法中,正确的是( )
| A. | 甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有三种 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 |
17.如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )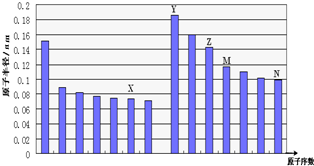

| A. | N、Z两种元素的离子半径相比前者较大 | |
| B. | M、N两种元素的气态氢化物的稳定性相比后者较强 | |
| C. | X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应 | |
| D. | X与Y两种元素组成的一种化合物中阴、阳离子的个数比为1:1 |
4.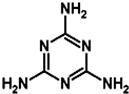 三聚氰胺是“三鹿奶粉事件”的罪魁祸首,其结构式如图所示.下列关于三聚氰胺的说法正确的是( )
三聚氰胺是“三鹿奶粉事件”的罪魁祸首,其结构式如图所示.下列关于三聚氰胺的说法正确的是( )
 三聚氰胺是“三鹿奶粉事件”的罪魁祸首,其结构式如图所示.下列关于三聚氰胺的说法正确的是( )
三聚氰胺是“三鹿奶粉事件”的罪魁祸首,其结构式如图所示.下列关于三聚氰胺的说法正确的是( )| A. | 三聚氰胺的分子式为C3H6N6 | |
| B. | 三聚氰胺分子中的所有原子均位于同一平面上 | |
| C. | 三聚氰胺的二溴取代物只有1种 | |
| D. | 三聚氰胺属于芳香烃 |
14.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是探究温度对H2O2分解速率的影响,实验①分别向两支试管中加入等量的H2O2溶液的目的是控制变量,
实验中滴加2滴FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
(2)实验①的目的是探究温度对H2O2分解速率的影响,实验①分别向两支试管中加入等量的H2O2溶液的目的是控制变量,
实验中滴加2滴FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
1.下列物质中,金属性最强的是( )
| A. | 钠 | B. | 镁 | C. | 铝 | D. | 硅 |
18.对于淀粉和纤维素这两种物质,下列说法正确的是( )
| A. | 二者都能水解,且水解的最终产物相同 | |
| B. | 它们都可用(C6H10O5)n表示,所以二者互为同分异构体 | |
| C. | 它们均属于糖类,都具有甜味,且都是高分子化合物 | |
| D. | 淀粉能发生银镜反应,而纤维素不能,但能发生酯化反应 |
1.下列物质属于芳香烃,但不是苯的同系物的是( )
| A. | 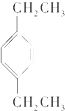 | B. | 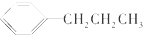 | C. | 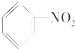 | D. | 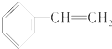 |