题目内容
【题目】取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化
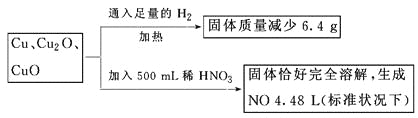
则转化过程中所加稀HNO3的物质的量浓度为
A. 4.4 mol·L-1 B. 3.6 mol·L-1 C. 4.0 mol·L-1 D. 3.2 mol·L-1
【答案】D
【解析】
试题设其中每一份中含有各部分的物质的量分别是:n(Cu)="x" mol,n(Cu2O)="y" mol,n(CuO)="z" mol,根据电子守恒可得2x+2y=(4.48L÷22.4L/mol)×3=0.6mol,根据氧元素守恒可得y+z=6.4g÷16g/mol=0.4mol;两个式子相加可得:x+2y+z=0.7mol,即反应后生成的硝酸铜的物质的量为0.70mol.所以在500mL稀硝酸中含有硝酸的物质的量是: n(HNO3)=0.70mol×2+0.20mol=1.600mol,硝酸的浓度是:c(HNO3)=n÷V=1.60mol/0.50L=3.2mol/L,因此选项是D。

练习册系列答案
相关题目






