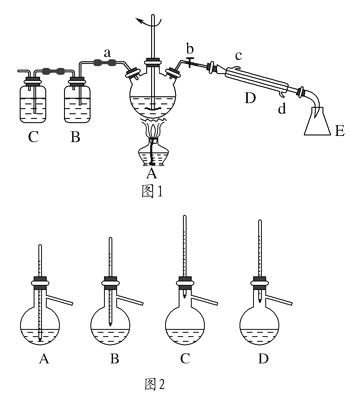
题目内容
【题目】常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示。下列说法正确的是

A. pH=10时,溶液中微粒浓度的关系是:c(M+)> c(Cl-)> c(MOH) >c(OH-)>c(H+)
B. 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度一直保持的关系是:c(R+)>c(M+)>c(OH-)>c(H+)
C. 10mL<V(HCl)<20mL时,溶液中微粒浓度的关系是:c(M+)+c(MOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
【答案】A
【解析】根据图知,未加HCl溶液时,ROH的pH=13,说明c(OH-)= c(ROH),为强碱;MOH的pH小于13,则MOH为弱碱;A.MOH溶液中加入10mLHCl 溶液时,溶液中的溶质为等物质的量浓度的MOH和MCl,溶液呈碱性,说明MOH电离程度大于MCl水解程度,MOH电离程度较小;B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,ROH已经完全反应,溶液中溶质为等物质的量浓度的MCl、RCl,MCl为强酸弱碱盐, M+水解导致溶液呈酸性,但水解程度较小;C.10mL<V(HCl)<20mL时,溶液中溶质为MOH和MCl,且c(MCl)>c(MOH),溶液中存在物料守恒;D.V(HCl)>20mL时,HCl过量导致溶液呈酸性,根据电荷守恒得c(Cl-)>c(M+),溶液中溶质存在有c(MCl)=c(HCl)、c(MCl)>c(HCl)、c(MCl)<c(HCl)三种情况。
根据图知,未加HCl溶液时,ROH的pH=13,说明c(OH-)=c(ROH),为强碱;MOH的pH小于13,则MOH为弱碱;A.MOH溶液中加入10mL 盐酸溶液时,溶液中的溶质为等物质的量浓度的MOH和MCl,溶液呈碱性,说明MOH电离程度大于MCl水解程度,MOH电离程度较小,氯离子不水解,所以c(Cl-)>c(MOH),A正确;将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,ROH已经完全反应,溶液中溶质为等物质的量浓度的MCl、RCl,MCl为强酸弱碱盐, M+水解导致溶液呈酸性,但水解程度较小,R+不水解,所以存在c(R+)>c(M+)>c(H+)>c(OH-),B正确;10mL<V(HCl)<20mL时,溶液中溶质为MOH和MCl,且c(MCl)>c(MOH),溶液中存在物料守恒c(M+)+c(MOH)<c(Cl-),C错误;V(HCl)>20mL时,HCl过量导致溶液呈酸性,根据电荷守恒得c(Cl-)>c(M+),溶液中溶质存在有c(MCl)=c(HCl)、c(MCl)>c(HCl)、c(MCl)<c(HCl)三种情况,可能出现c(Cl-)>c(M+)=c(H+)>c(OH-),D错误;正确选项A。