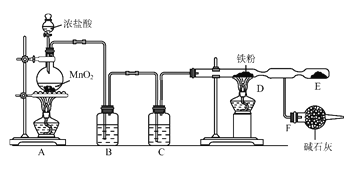
题目内容
【题目】请按下列要求填空:
(1)已知99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)常温下,HNO2 的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2 溶液中离子浓度由大到小的顺序是__________________
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① 乙烯电子式为_________
②b电极的名称是_________
③请写出电解时生成乙烯的电极反应式____________________________
【答案】 H2A=2H++A2- C c(NH4+)>c(A2-)>c(H+)>c(OH-) c(NO2- )>c(NH4+)>c(H+ )>c(OH-) ![]() 正 2CO2+12H++12e-=C2H4+4H2O
正 2CO2+12H++12e-=C2H4+4H2O
【解析】(1)99 ℃时,水的离子积常数Kw=1.0×10-12,=c2(H+),c(H+)=![]() =1.0×10-6,中性时pH=6。该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,Na2A是强酸强碱盐。①H2A是强酸,在水溶液中的电离方程式为 H2A=2H++A2- ,②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,n(H+)=c(H+)×V,氢离子浓度和体积相同,产生的氢气相同,故选C。③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,生成(NH4)2A,在水中电离成NH4+、A2-, NH4+水解使溶液呈酸性,溶液中各离子浓度从大到小的顺序为c(NH4+)>c(A2-)>c(H+)>c(OH-);(3)① 乙烯碳与碳形成双键,电子式为
=1.0×10-6,中性时pH=6。该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,Na2A是强酸强碱盐。①H2A是强酸,在水溶液中的电离方程式为 H2A=2H++A2- ,②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,n(H+)=c(H+)×V,氢离子浓度和体积相同,产生的氢气相同,故选C。③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,生成(NH4)2A,在水中电离成NH4+、A2-, NH4+水解使溶液呈酸性,溶液中各离子浓度从大到小的顺序为c(NH4+)>c(A2-)>c(H+)>c(OH-);(3)① 乙烯碳与碳形成双键,电子式为![]() ;②b电极上水失去电子产生氧气,故b电极名称是正极;③电解时生成乙烯的电极反应式2CO2+12H++12e-=C2H4+4H2O。
;②b电极上水失去电子产生氧气,故b电极名称是正极;③电解时生成乙烯的电极反应式2CO2+12H++12e-=C2H4+4H2O。

【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
t /min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(Lmin)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大