题目内容
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8kJ/mol.已知2Ag2O(s)=4Ag(s)+O2(g) ΔH=+62.2kJ/mol,则常温下反应: 2O3(g)=3O2(g)的ΔH= .
(2)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为 。
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8。写出该反应的化学方程式为: 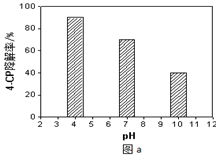

(4)所得的Na2S2O8溶液可降解有机污染物4-CP。原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-·)。通过测定4-CP降解率可判断Na2S2O8溶液产生SO4-·的量。某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4-·的影响。
①溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+。则由图示可知下列说法正确的是:_________________(填序号)
| A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。 |
| B.Fe2+是4-CP降解反应的催化剂 |
| C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。 |
| D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。 |
(1)-285.0KJ.mol-1(3分)
(2)3O2 + 6H+ +6e- = 3H2O2(或O2 +2H+ +2e- = H2O2) (3分)
(3)2Na2SO4 + O3 + H2O = Na2S2O8 + 2NaOH + O2 (3分)
(4) ①有利于 (2分)
②AC(2分)
③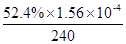
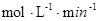 (3分)
(3分)
解析试题分析:(1)根据盖斯定律,所求方程式可由3×②-1×①而得,所以ΔH="3×(+62.2kJ/mol)" -2×(-235.8kJ/mol)= -285.0KJ.mol-1 。
(2)由于电解水法制臭氧实质是电解溶解有氧气的水溶液3O2 + 3H2O = O3↑+3H2O2 ,虽然酸性条件下,但算不参加反应,所以电解过程中阳极发生的氧化反应为H2O失电子变成臭氧,而不能是OH-,阴极发生的还原反应为O2得电子变成H2O2,所以阴极电极反应式为:O2 +2H+ +2e- = H2O2 ,若要阴阳极得失电子统一,也可写成3O2 + 6H+ +6e- = 3H2O2 。
(3)O3在碱性条件下将Na2SO4氧化成Na2S2O8的反应是一个氧化还原反应,要注意的是O3的性质和O2相比,臭氧有较强的氧化性,而且不稳定,容易变成为O2,所以在该反应中,O3中O原子不是全部做氧化剂,部分化合价不变;而Na2SO4 中S由+6价→+7价,所以找出相应的氧化剂、还原剂、氧化产物和还原产物后,用缺项配平书写化学方程式得:2Na2SO4 + O3 + H2O = Na2S2O8 + 2NaOH + O2 。
(4)①图a中明显可以看出,随着横坐标pH的增大,4-CP降解率逐渐减小,而起到降解作用的是具有强氧化性的自由基(SO4-·),所以讲解率降低说明强氧化自由基减少,所以酸性增强才有利于Na2S2O8产生SO4-·。
②根据图b可以看出,开始的一段时间内随着横坐标Fe2+浓度增大,4-CP降解率在增大,所以说明在这段时间内,Fe2+能使Na2S2O8产生更多的SO4-·,A正确。强氧化性自由基是通过S2O82- + Fe2+= SO4-·+ SO42- + Fe3+反应产生的,所以Fe2+ 不是讲解反应的催化剂,B错误;因为自由基SO4-·有强氧化性,所以若Fe2+ 浓度过大,则来不及反应的Fe2+ 会被生成的自由基氧化,导致自由基减少,降解率下降,C正确,D错误;故选AC。
③当c(Fe2+)=3.2 ×10-3 mol·L-1时,从图像b中可以找到此时的降解率52.4%,而初始浓度为c(4-CP)=1.56×10-4 mol·L-1 ,所以在240min内的反应速率v=△C/△t=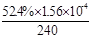
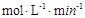 。
。
考点:本题考查的是盖斯定律应用、电化学中电极反应式的书写、氧化还原反应方程式的配平、化学反应速率的计算等问题。

某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案: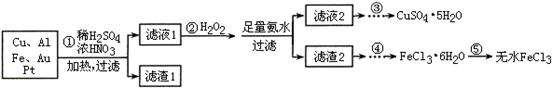
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
此产品中CuSO4·5H2O的质量分数为 。
硫、氮、稀土元素的单质和化合物应用广泛。
Ⅰ.(1)将硫铁矿和焦炭放在炼硫炉中,在有限空气中燃烧,发生下列反应:
3FeS2 + 12 C + 8O2 = Fe3O4 + 12CO + 6S
生成3mol硫时,被氧化的物质物质的量为__ _________。
(2)过硫酸钾化学式为:K2S2O8,过硫酸结构式为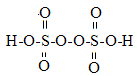
①过硫酸钾和过硫酸均有强氧化性,不稳定,容易分解,如2H2S2O8=2H2SO4+2SO3+O2
下列能加快过硫酸分解的固体物质是 。
| A.CuO | B.MnO2 | C.Fe2O3 | D.NaNO3 |
③若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,由CeCl3·6H2O制备无水CeCl3应采取的措施是 _ _。