��Ŀ����
�⻯��ͭ(CuH)��һ���������ʣ���CuSO4��Һ�͡���һ���ʡ���40��50��ʱ��Ӧ����������CuH���е������У����ȶ����ֽ⣻����������ȼ�գ���ϡ���ᷴӦ���������壻Cu�������������·����ķ�Ӧ�ǣ�2Cu��=Cu2����Cu��
����������Ϣ������Լ������յĻ�ѧ֪ʶ���ش��������⣺
(1)��CuSO4��Һ�͡���һ���ʡ���CuH�ķ�Ӧ�У���������ԭ�۵�������⡰��һ���ʡ��ڷ�Ӧ����______(�����������ԭ����)��
(2)д��CuH��������ȼ�յĻ�ѧ��Ӧ����ʽ��________________________��
(3)CuH�ܽ���ϡ���������ɵ�������______(�ѧʽ)��
(4)�����CuH�ܽ���������ϡ���������ɵ�����ֻ��NO����д��CuH�ܽ�������ϡ�����з�Ӧ�����ӷ���ʽ��_____________________________________��
(1)��ԭ��
(2)2CuH��3Cl2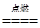 2CuCl2��2HCl
2CuCl2��2HCl
(3)H2
(4)CuH��3H����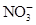 =Cu2����2H2O��NO��
=Cu2����2H2O��NO��
����

��������(H2O2)��һ����ɫ��Һ��,����ˮ��Һ�׳�˫��ˮ,��������,����������������ɱ������Ư���ȡ�
(1)����˵����ȷ���� ��
| A��������������м��м��Լ����зǼ��Լ� |
| B��H2O2��H2O��Ϊͬ�������� |
| C��34 g H2O2�к��е���������ΪNA |
| D��ʵ���ҿ������ù���������ȡ���� |
(3)��H2O2��Һ��������FeCl2��Һ��,��Һ��dz��ɫ��Ϊ�ػ�ɫ,д���÷�Ӧ�����ӷ���ʽ: ��
(4)ij����ҵ��ˮ�к���һ��������,Ϊ�˳�ȥ����,������H2O2�����ȼ�,д���÷�Ӧ�Ļ�ѧ����ʽ: ��
���������ھ�������������ˮ��������������ҵ�������������.
��1���������������������ҿ������������е��ʷ�Ӧ����:6Ag(s)+O3(g)=3Ag2O(s) ��H=-235.8kJ/mol.��֪2Ag2O(s)=4Ag(s)+O2(g) ��H=+62.2kJ/mol,�����·�Ӧ: 2O3(g)=3O2(g)�Ħ�H= .
��2����ѧ��P.Tatapudi��������ʹ�������������µ��ˮ�ķ����Ƶó�����������������Χ��ˮ�в���,�缫��ӦʽΪ3H2O-6e-=O3��+6H+,���������ܽ���ˮ�е��������ɹ�������,��缫��ӦʽΪ ��
��3��O3�ڼ��������¿ɽ�Na2SO4������Na2S2O8��д���÷�Ӧ�Ļ�ѧ����ʽΪ�� 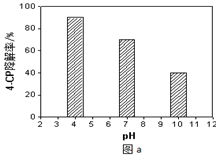

��4�����õ�Na2S2O8��Һ�ɽ����л���Ⱦ��4-CP��ԭ����Na2S2O8��Һ��һ�������¿ɲ���ǿ���������ɻ���SO4-������ͨ���ⶨ4-CP�����ʿ��ж�Na2S2O8��Һ����SO4-��������ij�о�С�����ʵ��̽������Һ����ԡ�Fe2+��Ũ�ȶԲ���SO4-����Ӱ�졣
����Һ����Ե�Ӱ�죺����������ͬ����4-CP���뵽��ͬpH��Na2S2O8��Һ�У������ͼa��ʾ���ɴ˿�֪����Һ������ǿ�� ���� �������ڡ������ڡ���Na2S2O8����SO4-����
��Fe2+Ũ�ȵ�Ӱ�죺��ͬ�����£�����ͬŨ�ȵ�FeSO4��Һ�ֱ����c(4-CP)=1.56��10-4 mol��L��1��c(Na2S2O8)=3.12��10-3 mol��L��1�Ļ����Һ�С���Ӧ240 min����ʵ������ͼb��ʾ����֪ S2O82- + Fe2+= SO4-��+ SO42- + Fe3+������ͼʾ��֪����˵����ȷ���ǣ�_________________������ţ�
| A����Ӧ��ʼһ��ʱ���ڣ� 4-CP��������Fe2+Ũ�ȵ������������ԭ����Fe2+��ʹNa2S2O8���������SO4-���� |
| B��Fe2+��4-CP���ⷴӦ�Ĵ��� |
| C����c(Fe2+)����ʱ��4-CP�����ʷ����½���ԭ�������Fe2+����SO4����������Ӧ�����IJ���SO4������ |
| D��4-CP�����ʷ����½���ԭ����������ɵ�Fe3+ˮ��ʹ��Һ��������ǿ�������ڽ��ⷴӦ�Ľ��С� |
ŷ��ԭ����2012��1��1�������պ���̼��˰��Ӧ�Ա����ڻ���ȫ���ů��ʹ�ö���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Եø��ӽ��ȡ������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1�����������ҹ���������̼���о�ȡ���ش��չ���õ绡���ϳɵ�̼�����г����д���̼�����������ʣ�������̼���������������������ᴿ���䷴Ӧ�Ļ�ѧ����ʽΪ��
__C+__K2Cr2O7+__ ��__CO2��+ __K2SO4 + __Cr2(SO4)3+__H2O
����ɲ���ƽ������ѧ����ʽ��
��2���״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+ 2H2��g�� CH3OH��g�� ��H1����116 kJ��mol-1
CH3OH��g�� ��H1����116 kJ��mol-1
�����д�ʩ������������÷�Ӧ�ķ�Ӧ���ʵ��� _______��
| A����ʱ��CH3OH�뷴Ӧ�������� | B�����ͷ�Ӧ�¶� |
| C��������ϵѹǿ | D��ʹ�ø�Ч���� |
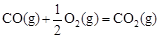 ��H2����283 kJ��mol-1
��H2����283 kJ��mol-1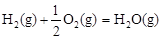 ��H3����242 kJ��mol-1
��H3����242 kJ��mol-1���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ����ʱ���Ȼ�ѧ����ʽΪ ��
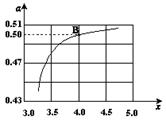
�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250���270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ����ش�:
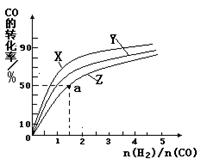
���������������¶��У�����Z��Ӧ���¶���
��������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶���CO��g��+ 2H2��g��
 CH3OH��g����ƽ�ⳣ��K = ��
CH3OH��g����ƽ�ⳣ��K = �� 
 2NO2 (g) ���� һ���¶��£���Ӧ�����ʱ�Ϊ��H���ֽ�1 mol N2O4 ����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________��
2NO2 (g) ���� һ���¶��£���Ӧ�����ʱ�Ϊ��H���ֽ�1 mol N2O4 ����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________��
 CO(NH2)2 (l) + H2O (l)��
CO(NH2)2 (l) + H2O (l)��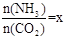 ����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ����___________��
����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ����___________��