��Ŀ����
����ϡ��Ԫ�صĵ��ʺͻ�����Ӧ�ù㷺��
��1����������ͽ�̿��������¯�У�����������ȼ�գ��������з�Ӧ��
3FeS2 + 12 C + 8O2 = Fe3O4 + 12CO + 6S
����3mol��ʱ�����������������ʵ���Ϊ__ _________��
��2��������ػ�ѧʽΪ��K2S2O8��������ṹʽΪ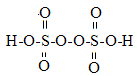
�ٹ�����غ��������ǿ�����ԣ����ȶ������ֽ⣬��2H2S2O8=2H2SO4+2SO3+O2
�����ܼӿ������ֽ�Ĺ��������� ��
| A��CuO | B��MnO2 | C��Fe2O3 | D��NaNO3 |
�����÷�Ӧ���õ������̸�Ϊ�Ȼ��̣������������Ĺ�����ط�Ӧʱ�����и�����ء�����ء����������⣬�����������ﻹ��_________________��
��ϡ��Ԫ���DZ����ս����Դ���ҹ����̲�����������λ����(Ce)�ǵؿ��к�����ߵ�ϡ��Ԫ�ء��ڼ���������CeCl3����ˮ�⣬��CeCl3·6H2O�Ʊ���ˮCeCl3Ӧ��ȡ�Ĵ�ʩ�� _ _��
��1��7.5mol (2��)
��2����ABC(ȫ�Ը�2�֣��д�0�֣�ȱ�����1��)
��8H2O + 2MnSO4 + 5K2S2O8 = 2KMnO4 + 4K2SO4 + 8H2SO4(2�֣�����ƽ��ѧʽ���ִ����Ϊ0�֣�д���ӷ���ʽ��ȫ��ȷ��1�֣��д�0��)
������(2��)(����ʽ�����ƾ���)
����ͨ���Ȼ�������������¼��ȳ�ȥ�ᾧˮ(2��)
���������������1���ӻ�ѧ����ʽ�ɿ���Fe��S��C����Ԫ�صĻ��ϼ۾����ߣ����Ա�����������ΪFeS2��C������3mol��ʱ����������FeS2Ϊ1.5mol����������CΪ6mol��7.5mol����2�� �����CuO��MnO2��Fe2O3�Թ�������ֽ�Ĵ����ÿ������жϣ��ڷ�Ӧ������H2SO4˵����ˮ�μӷ�Ӧ�����ݻ��ϼ۱仯�����ƽ�û�ѧ����ʽ��8H2O + 2MnSO4 + 5K2S2O8 = 2KMnO4 + 4K2SO4 + 8H2SO4����K2S2O8�����Ա�KMnO4ǿ���ɰ�Cl�C����Ϊ�������������ﻹ����������Ϊ����CeCl3ˮ�⣬CeCl3·6H2OӦ���Ȼ��������м��ȳ�ȥ�ᾧˮ�Ʊ���ˮCeCl3��
���㣺��Ҫ����������ԭ��Ӧ������ƽ����ѧ����ʽ����д���ε�ˮ�⣬�����ۺϷ���������

���������ھ�������������ˮ��������������ҵ�������������.
��1���������������������ҿ������������е��ʷ�Ӧ����:6Ag(s)+O3(g)=3Ag2O(s) ��H=-235.8kJ/mol.��֪2Ag2O(s)=4Ag(s)+O2(g) ��H=+62.2kJ/mol,�����·�Ӧ: 2O3(g)=3O2(g)�Ħ�H= .
��2����ѧ��P.Tatapudi��������ʹ�������������µ��ˮ�ķ����Ƶó�����������������Χ��ˮ�в���,�缫��ӦʽΪ3H2O-6e-=O3��+6H+,���������ܽ���ˮ�е��������ɹ�������,��缫��ӦʽΪ ��
��3��O3�ڼ��������¿ɽ�Na2SO4������Na2S2O8��д���÷�Ӧ�Ļ�ѧ����ʽΪ�� 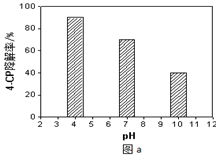

��4�����õ�Na2S2O8��Һ�ɽ����л���Ⱦ��4-CP��ԭ����Na2S2O8��Һ��һ�������¿ɲ���ǿ���������ɻ���SO4-������ͨ���ⶨ4-CP�����ʿ��ж�Na2S2O8��Һ����SO4-��������ij�о�С�����ʵ��̽������Һ����ԡ�Fe2+��Ũ�ȶԲ���SO4-����Ӱ�졣
����Һ����Ե�Ӱ�죺����������ͬ����4-CP���뵽��ͬpH��Na2S2O8��Һ�У������ͼa��ʾ���ɴ˿�֪����Һ������ǿ�� ���� �������ڡ������ڡ���Na2S2O8����SO4-����
��Fe2+Ũ�ȵ�Ӱ�죺��ͬ�����£�����ͬŨ�ȵ�FeSO4��Һ�ֱ����c(4-CP)=1.56��10-4 mol��L��1��c(Na2S2O8)=3.12��10-3 mol��L��1�Ļ����Һ�С���Ӧ240 min����ʵ������ͼb��ʾ����֪ S2O82- + Fe2+= SO4-��+ SO42- + Fe3+������ͼʾ��֪����˵����ȷ���ǣ�_________________������ţ�
| A����Ӧ��ʼһ��ʱ���ڣ� 4-CP��������Fe2+Ũ�ȵ������������ԭ����Fe2+��ʹNa2S2O8���������SO4-���� |
| B��Fe2+��4-CP���ⷴӦ�Ĵ��� |
| C����c(Fe2+)����ʱ��4-CP�����ʷ����½���ԭ�������Fe2+����SO4����������Ӧ�����IJ���SO4������ |
| D��4-CP�����ʷ����½���ԭ����������ɵ�Fe3+ˮ��ʹ��Һ��������ǿ�������ڽ��ⷴӦ�Ľ��С� |
��֪������ԭ��Ӧ�����ֻ�����Ӧ���͵Ĺ�ϵ������ͼ��ʾ����������ˮ�μӻ����ɵļ��ַ�Ӧ��
��CaO+H2O =Ca(OH)2
��2Na+H2O=2NaOH+H2��
��H2+CuO  Cu +H2O
Cu +H2O
��3S+6NaOH  2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
��NaOH+HCl=NaCl+H2O
��ش��������⣺
��1����Ӧ����ˮ ������ĸ����
| A���������� |
| B���ǻ�ԭ�� |
| C���������������ǻ�ԭ�� |
| D���Ȳ����������ֲ��ǻ�ԭ�� |
��3��������Ӧ�У������������� ������ţ���
��4��д��һ�ַ���������Ҽ��г�����������ˮ���ɵ����ӷ���ʽ�� ��
ŷ��ԭ����2012��1��1�������պ���̼��˰��Ӧ�Ա����ڻ���ȫ���ů��ʹ�ö���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Եø��ӽ��ȡ������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1�����������ҹ���������̼���о�ȡ���ش��չ���õ绡���ϳɵ�̼�����г����д���̼�����������ʣ�������̼���������������������ᴿ���䷴Ӧ�Ļ�ѧ����ʽΪ��
__C+__K2Cr2O7+__ ��__CO2��+ __K2SO4 + __Cr2(SO4)3+__H2O
����ɲ���ƽ������ѧ����ʽ��
��2���״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+ 2H2��g�� CH3OH��g�� ��H1����116 kJ��mol-1
CH3OH��g�� ��H1����116 kJ��mol-1
�����д�ʩ������������÷�Ӧ�ķ�Ӧ���ʵ��� _______��
| A����ʱ��CH3OH�뷴Ӧ�������� | B�����ͷ�Ӧ�¶� |
| C��������ϵѹǿ | D��ʹ�ø�Ч���� |
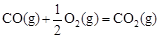 ��H2����283 kJ��mol-1
��H2����283 kJ��mol-1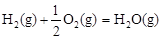 ��H3����242 kJ��mol-1
��H3����242 kJ��mol-1���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ����ʱ���Ȼ�ѧ����ʽΪ ��
�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250���270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ����ش�:
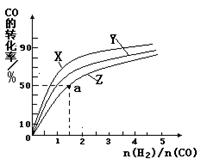
���������������¶��У�����Z��Ӧ���¶���
��������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶���CO��g��+ 2H2��g��
 CH3OH��g����ƽ�ⳣ��K = ��
CH3OH��g����ƽ�ⳣ��K = �� ˮ��������������Ҫ���ʣ��й�ˮ�ķ�Ӧʵ���кܶࡣ
(1)�������뽫̫����ת��Ϊ���ܣ�������ˮ�������������������һ�������Դ����������ˮ�Ĺ����У�ˮ��_____________(�����������������ԭ���ȱ������ֱ���ԭ���Ȳ��������ֲ�����ԭ)
(2)ҰӪ������Я���⻯�ƹ�����Ϊ�����������ʽΪCaH2+2H2O=Ca(OH)2+2H2��,����ˮ��_____________(�����������������ԭ���ȱ������ֱ���ԭ���Ȳ��������ֲ�����ԭ)
(3)�����з�Ӧ��ˮֻ����ԭ����_____________������ţ�
| A��C+H2O=CO+H2 | B��CaO+H2O=Ca(OH)2 |
| C��3Fe+4H2O=Fe3O4+4H2 | D��3NO2+H2O=2HNO3+NO |
3NO2+H2O=2HNO3+NO
 HSO3 -+H+ K=1.5��10-2
HSO3 -+H+ K=1.5��10-2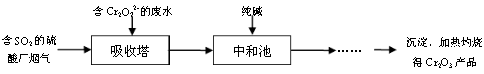
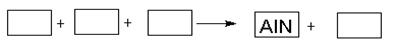
 AlN+3HCl��Ӧ�У��÷�����ǰ���������ϸ������ơ�����˵���У���ȷ������������������������ �� ��
AlN+3HCl��Ӧ�У��÷�����ǰ���������ϸ������ơ�����˵���У���ȷ������������������������ �� ��