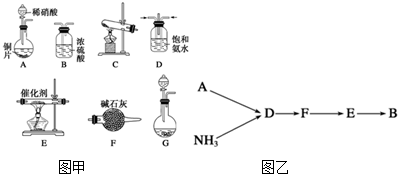
题目内容
16.蒸干并灼烧下列物质的水溶液,仍能得到该物质的是( )| A. | 氯化铝 | B. | 碳酸氢钠 | C. | 硫酸亚铁 | D. | 碳酸钠 |
分析 从盐类水解的角度和物质的稳定性的角度分析,当水解生成挥发性酸时,加热蒸干并灼烧最终得到的是金属氧化物,当水解生成非挥发性酸时,加热蒸干并灼烧最终得到的是原物质.
解答 解:A.氯化铝易水解生成HCl和氢氧化铝,升高温度促进盐酸挥发,所以蒸干溶液时得到氢氧化铝,灼烧时氢氧化铝分解生成氧化铝,所以最终得到的是氧化铝,故A错误;
B.碳酸氢钠不稳定,受热易分解生成碳酸钠,所以蒸干、灼烧碳酸氢钠溶液时得到的是碳酸钠,故B错误;
C.硫酸亚铁不稳定,易被氧气氧化生成硫酸铁,所以得不到原来物质,故C错误;
D.碳酸钠较稳定,受热不易分解,蒸干溶液时仍然得到原来溶质,故D正确;
故选D.
点评 本题考查盐类水解及物质的稳定性,明确物质性质是解本题关键,注意根据盐类物质特点确定是否得到原来物质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.某有机物A的结构为CH3-CH=CH-CH2OH,它不可能发生的反应是( )
| A. | 与氢氧化钠溶液反应 | B. | 使溴的四氯化碳溶液褪色 | ||
| C. | 与金属钠反应放出氢气 | D. | 使高锰酸钾溶液褪色 |
7.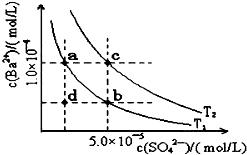 已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )
已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )
 已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )
已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )| A. | 温度为T1时,在T1曲线上方区域任意一点时,均有BaSO4沉淀生成 | |
| B. | 蒸发溶剂可能使溶液由d点变为T1曲线上a、b之间的某一点 | |
| C. | 升温可使溶液由b点变为d点 | |
| D. | T2>25℃ |
4.下列物质中属于弱电解质的是( )
| A. | 氨水 | B. | 金属铜 | C. | 醋酸 | D. | 苯 |
11.下列离子方程式正确的是( )
| A. | 铁粉加入三氯化铁溶液中 Fe+Fe3+═2Fe2+ | |
| B. | Cl2与水的反应Cl2+H2O═2H++Cl-+ClO- | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
1.下列事实不能用化学平衡移动原理解释的是( )
| A. | 收集氯气可以用排饱和食盐水的方法 | |
| B. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| C. | 加催化剂,使N2和H2在一定的条件下转化为NH3 | |
| D. | 20℃时,AgCl在蒸馏水中的溶解度比在0.1mol/LNaCl溶液中的溶解度大 |
5.a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族,a的原子结构示意图为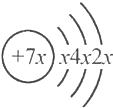 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,下列比较中,正确的是( )
 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,下列比较中,正确的是( )| A. | 原子序数:a>b>c | B. | 氢化物的稳定性:a>c>d | ||
| C. | 原子半径:d>a>c | D. | 最高价含氧酸的酸性:d>c>a |
6.某待测无色溶液中滴入酚酞试剂,结果溶液呈红色,由此可得出的结论是( )
| A. | 溶液中溶有NaOH | B. | 溶质可能是Cu2(OH)2CO3 | ||
| C. | 溶液中一定不含有H+离子 | D. | 溶液呈碱性 |