题目内容
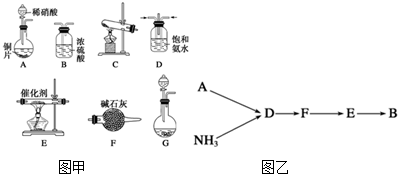
8.除去工业尾气中的氮氧物,常用氨催化吸收法原理是NH3与NOx反应生成无毒物质.某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程.(一)提供的装置如图甲.
(二)NH3的制取
(1)下列有关实验室.制备气体的说法正确的有②③(填序号).
①用赤热的炭与水蒸气反应制取氢气 ②用排饱和食盐水的方法收集氯气
③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气
(2)若选择装置G制取氨气,则分液漏斗中盛装的液体试剂是浓氨水.
(3)若选择装置C制取氨气,则反应的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(三)模拟尾气的处理
选用图甲部分装置,按如图乙顺序接成模拟尾气处理装置,回答有关问题:
(4)A装置中反应的离子方程式为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O.
(5)D装置中的液体可换成c(填序号)
a.CuSO4 b.H2O c.CCl4 d.浓硫酸
(6)该同学所设计的模拟尾气处理实验存在的明显是NO直接排放,缺少尾气吸收装置.
分析 (1)①用赤热的炭与水蒸气反应制取氢气氢气含有一氧化碳、水蒸气等;
②氯气难溶于饱和食盐水,可用排饱和食盐水集气法收集;
③用高锰酸钾、氯酸钾制取氧气时需要加热,用双氧水分解获得氧气不需要加热;
④氨气与氯化钙发生反应,所以不能使用无水氯化钙干燥氨气;
(2)依据G装置特点,固体、液体不加热制备气体选择试剂;
(3)实验室用氯化铵与氢氧化钙固体加热制备氨气;
(4)铜与稀硝酸反应生成硝酸铜和一氧化氮和水;
(5)氨气为极性分子,不溶于非极性溶剂;
(6)一氧化氮有毒,过量的NO会污染空气.
解答 解:(1)①赤热的炭与水蒸气反应生成一氧化碳和氢气,制取的氢气不纯,操作方法复杂,实验室通常使用锌与稀硫酸反应制取氢气,故错误;
②氯气难溶于饱和食盐水,实验室制备Cl2,可用排饱和食盐水集气法收集,故正确;
③实验室用高锰酸钾、氯酸钾制取氧气时需要加热,用双氧水分解获得氧气不需要加热,故正确;
④用无水氯化钙干燥氨气:氨气与氯化钙发生反应,不能使用无水氯化钙干燥氨气,故错误;
故选:②③;
(2)G装置特点,固体、液体不加热制备气体,而实验室通常用浓氨水滴加到生石灰上制取氨气;
故答案为:浓氨水;
(3)实验室用氯化铵与氢氧化钙固体加热制备氨气,反应的化学方程式:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
(4)铜与稀硝酸反应生成硝酸铜和一氧化氮和水,离子方程式:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O;
故答案为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O;
(5)氨气可溶于硫酸铜溶液、水以及硫酸中,会产生倒吸,氨气为极性分子,不溶于非极性溶剂,可用CCl4代替饱和氨水,所以c正确,
故选:c;
(6)NO有毒,能够造成空气污染,图示装置中缺少尾气处理装置,过量的NO会污染空气;
故答案为:NO直接排放,缺少尾气吸收装置;
点评 本题通过常见气体的性质及制备,熟悉气体制备原理和装置的选择原则是解题关键,注意防倒吸装置的原理的理解.

| A. | CH3C18OOH与C2H518OH | B. | CH3C18O18OH与C2H518OH | ||
| C. | CH3CO18OH与C2H518OH | D. | CH3CO18OH 与C2H5OH |
| A. | 氯化铝 | B. | 碳酸氢钠 | C. | 硫酸亚铁 | D. | 碳酸钠 |
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 2.4gMg溶于足量稀盐酸,转移的电子数为0.1NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 的数目为NA |
| A. | 铀(U)的两种核素:${\;}_{92}^{235}$U和${\;}_{92}^{238}$U | |
| B. | CO2的结构式:O=C=O | |
| C. | 乙醇分子的比例模型: | |
| D. | Cl-结构示意图: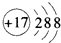 |
| A. | 形成四对共用电子对 | B. | 通过非极性键 | ||
| C. | 通过两个共价键 | D. | 通过离子键和共价键 |
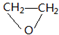 .
.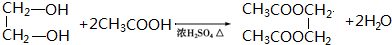 .
.