题目内容
7.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S>Se.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
分析 ①同周期元素随原子序数的增大,原子半径减小,具有相同电子排布的离子,原子序数的大的,半径小,阴离子的半径大于原子的半径;
②非金属性越强,气态氢化物的稳定性越强;
③非金属性越强,对应离子的还原性越弱;
④非金属性越强,对应单质的氧化性越强;
⑤非金属性越强,对应最高价氧化物的水化物的酸性越强;
⑥同主族元素,电子层数越多,得电子能力越弱,同周期原子序数越大,得电子能力越强.
解答 解:①同周期元素随原子序数的增大,原子半径减小,则S>Cl,具有相同电子排布的离子,原子序数的大的,半径小,则S2->Cl-,阴离子的半径大于原子的半径,S2->S,Cl->Cl,但无法确定Cl->S,故①错误;
②非金属性F>Cl>S>Se,气态氢化物的稳定性为HF>HCl>H2S>H2Se,故②正确;
③非金属性Cl>Br>I>S,对应离子的还原性为S2->I->Br->Cl-,故③错误;
④非金属性Cl>S>Se>Te,对应单质的氧化性为Cl2>S>Se>Te,故④正确;
⑤非金属性Cl>S>Se,对应最高价氧化物的水化物的酸性为H4ClO4>H2SO4>H2SeO4,故⑤错误;
⑥同主族元素,电子层数越多,得电子能力越弱,同周期元素原子序数越大,得电子能力越强,则电子能力为F>Cl>S>Se,故⑥正确;
故选C.
点评 本题考查非金属元素的性质,明确同周期、同主族元素的性质变化规律及元素非金属性的比较方法是解答本题的关键,难度不大.

练习册系列答案
相关题目
17.下列表示的是丙基的是( )
| A. | CH3 CH2CH3 | B. | CH3 CH2CH2- | C. | -CH2CH2CH2- | D. | (CH3 )2CH- |
15.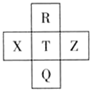 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z>T>X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | R、T、Q的最高正价相同 |
2.从某些植物树叶提取的挥发油中含有下列主要成分:
A.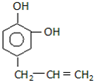 B.
B.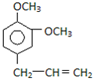 C.
C.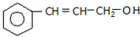
(1)2mol A与溴水充分反应,需消耗8 mol单质溴.
(2)写出B的分子式C11H14O2
(3)C与氢气完全加成后产物的结构简式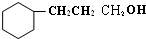 .
.
A.
 B.
B. C.
C.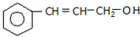
(1)2mol A与溴水充分反应,需消耗8 mol单质溴.
(2)写出B的分子式C11H14O2
(3)C与氢气完全加成后产物的结构简式
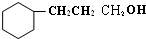 .
.
12. 将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
 将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )| A. | 由图可以确定该镁铝合金中铝的质量为0.27g | |
| B. | 当滴入1mo1•L-1的NaOH溶液85mL时,所得沉淀为Mg(OH)2和Al(OH)3 | |
| C. | 由图可以确定a的取值范围为:0≤a≤50 | |
| D. | 由图可以确定该合金中镁铝物质的量之比0<$\frac{n(Mg)}{n(AI)}$<2.5 |
19.${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、H+、H2是( )
| A. | 氢的五种不同粒子 | B. | 五种氢元素 | ||
| C. | 氢的五种同素异形体 | D. | 氢元素的五种同位素 |
17.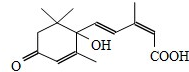 节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
 节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )| A. | 1mol该分子可与1molNa发生反应产生H2 | |
| B. | 分子中含有两种官能团 | |
| C. | 可发生加成反应和取代反应 | |
| D. | 该分子不能使酸性高锰酸钾溶液褪色 |