题目内容
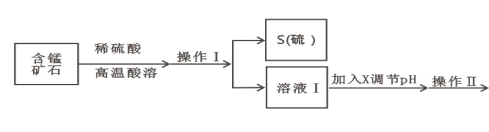
【题目】某含锰矿石的主要成分是 MnO2,还含 CaO、Al2O3、FeS 杂质,由此矿石生产 MnCO3 的工艺流 程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的 pH 如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸_____(填“ 是” 或“ 否” );操作 I 的名称 为_____。
(2)取溶液Ⅰ加入 KSCN 溶液,溶液呈血红色,试写出酸溶过程中 MnO2 与 FeS 发生反应的离子方程 式:_____。
(3)调节溶液Ⅰ的 pH 时,pH 的范围为_____;所用的物质 X 最好是_____(填字母)。
A.盐酸 B.NaOH 溶液 C.氨水 D.MnCO3 固体
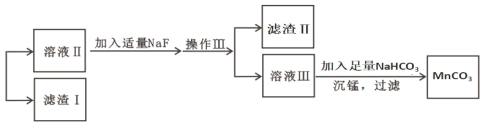
(4)滤渣Ⅰ为_____,滤渣Ⅱ为_____。(填化学式)
(5)沉锰的化学方程式为_____。
(6)沉锰后过滤得到固体 MnCO3,设计实验方案验证 MnCO3 固体是否洗涤干净:_____。
【答案】否 过滤 2FeS + 12H+ + 3MnO2 = 2Fe3+ + 2S + 3Mn2+ + 6H2O 4.7≤pH<8.8 D Fe(OH)3、Al(OH)3 CaF2 MnSO4 + 2NaHCO3 = MnCO3↓ + Na2SO4 + H2O + CO2↑ 取少量最后一次洗涤液于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀产生,则说明已经洗涤干净。
【解析】
(1)酸溶时的条件为高温,盐酸沸点低,在高温下易挥发,不宜用盐酸;操作Ⅰ得到单质S沉淀,所以操作为过滤;故答案为:否、过滤;
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,说明有铁离子生成,所以酸溶过程中FeS发生反应的离子方程式为FeS + 12H+ +3MnO2![]() 2Fe3+ + 2S↓ + 3Mn2+ + 6H2O;故答案为:2FeS + 12H+ + 3MnO2 = 2Fe3+ + 2S + 3Mn2+ + 6H2O;
2Fe3+ + 2S↓ + 3Mn2+ + 6H2O;故答案为:2FeS + 12H+ + 3MnO2 = 2Fe3+ + 2S + 3Mn2+ + 6H2O;
(3)调节溶液Ⅰ的 pH目的是为了除去铁离子和铝离子,同时又不能让Mn2+转化为沉淀,则pH应控制在4.7至8.8之间;由于不能引入杂质,则调节溶液pH所用物质X最好为 MnCO3固体;故答案为:4.7≤pH<8.8、D;
(4)根据表中数据可知铁离子、铝离子完全沉淀,则滤渣Ⅰ为Al(OH)3、Fe(OH)3;滤液中还含有钙离子,则加入NaF后转化为氟化钙沉淀,即滤渣Ⅱ为CaF2。故答案为:Fe(OH)3、Al(OH)3;CaF2;
(5)沉锰的反应物是碳酸氢钠和硫酸锰,则反应的化学方程式为MnSO4 + 2NaHCO3 = MnCO3↓ + Na2SO4 + H2O + CO2↑。
(6)沉锰后过滤得到固体表面可能含有SO42-,若洗涤干净后的洗涤液中不含硫酸根离子,故答案为:取少量最后一次洗涤液于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀产生,则说明已经洗涤干净。