题目内容
【题目】在某100 mL混合酸溶液中,HNO3和H2SO4的物质的量浓度分别为0.2 mol·L-1和0.4 mol·L-1,向该混合溶液中加入2.24 g铁粉,加热充分反应后,下列说法不正确的是
A. 生成的气体在标准状况下的体积为672 mLB. 生成的气体有NO和H2
C. 所得溶液中有溶质FeSO4和Fe2(SO4)3D. 所得溶液中Fe2+的物质的量浓度为0.4 mol·L-1
【答案】C
【解析】
计算氢离子总物质的量、硝酸根的物质的量判断,铁粉和氢离子过量,根据反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O、Fe+2H+═Fe2++H2↑进行过量计算,根据不足量的硝酸根计算生成NO物质的量,根据铁粉和氢离子过量进而计算生成氢气的物质的量,进而计算Fe2+的物质的量浓度。
n(HNO3)=cv=0.2molL1×0.100 L=0.020mol, n(H2SO4)=cv=0.4molL1×0.100 L=0.040mol,100mLHNO3和H2SO4混合酸溶液中,n(H+)=0.02moL+2×0.04moL=0.10mol,n(NO3)=0.020mol,n(Fe)=![]() =
=![]() =0.040mol,
=0.040mol,
所以向该混合液中加入2.24g铁粉,加热先发生反应:
3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
物质的量:0.03 0.08 0.02 0.03 0.02
反应后剩余的0.02molH+发生下列反应:
Fe+2H+═Fe2++H2↑
物质的量:0.01 0.02 0.01 0.01,则
A. 生成的气体有NO和H2共0.03mol,生成的气体在标准状况下的体积为V=n×![]() Vm=0.03mol×22.4L/mol=672mL,A项正确;
Vm=0.03mol×22.4L/mol=672mL,A项正确;
B. 根据以上分析生成的气体有NO和H2,B项正确;
C. 因NO3少量所得溶液中溶质只有FeSO4,C项错误;
D. 溶液中Fe2+的物质的量为:0.03 mol+0.01 mol=0.04 mol,100mL混合酸溶液中,浓度为c= ![]() = 0.4molL1,D项正确;
= 0.4molL1,D项正确;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
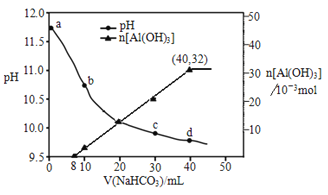
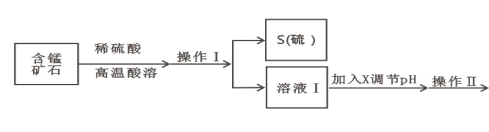
小学生10分钟应用题系列答案【题目】某含锰矿石的主要成分是 MnO2,还含 CaO、Al2O3、FeS 杂质,由此矿石生产 MnCO3 的工艺流 程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的 pH 如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸_____(填“ 是” 或“ 否” );操作 I 的名称 为_____。
(2)取溶液Ⅰ加入 KSCN 溶液,溶液呈血红色,试写出酸溶过程中 MnO2 与 FeS 发生反应的离子方程 式:_____。
(3)调节溶液Ⅰ的 pH 时,pH 的范围为_____;所用的物质 X 最好是_____(填字母)。
A.盐酸 B.NaOH 溶液 C.氨水 D.MnCO3 固体
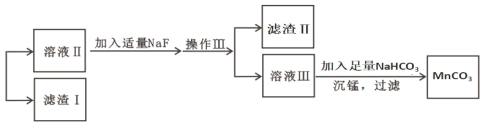
(4)滤渣Ⅰ为_____,滤渣Ⅱ为_____。(填化学式)
(5)沉锰的化学方程式为_____。
(6)沉锰后过滤得到固体 MnCO3,设计实验方案验证 MnCO3 固体是否洗涤干净:_____。