��Ŀ����
����Ŀ����ҵ����ƽ�VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5���������£�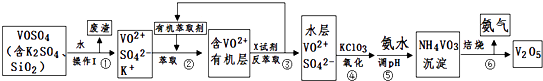
��ش��������⣺
��1����������÷����ijɷ�����д��ѧʽ��������I������ ��
��2������ڡ��۵ı仯���̿ɼ�Ϊ����ʽR��ʾVO2+ �� HA��ʾ�л���ȡ������R2��SO4��n ��ˮ�㣩+2nHA���л��㣩2RAn���л��㣩+nH2SO4 ��ˮ�㣩
������ȡʱ��������������ԭ���� ��
����X�Լ�Ϊ ��
��3���ܵ����ӷ���ʽΪ ��
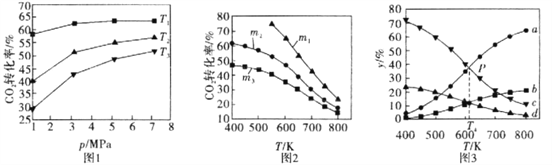
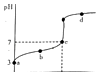
��4��25��ʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
����ϱ�����ʵ�������У����м��백ˮ��������Һ�����pHΪ �� ����������Ϊ93.1%ʱ������Fe��OH��3����������Һ��c��Fe3+���� �� ����֪��25��ʱ��Ksp[Fe��OH��3]=2.6��10��39��
��5���ù��������У�����ѭ�����õ��������� ��
���𰸡�
��1��SiO2������
��2��������кͲ������ᣬƽ����������˷�����ȡ�ʣ�����
��3��ClO3��+6VO2++9H2O=Cl��+6VO3��+18H+
��4��1.7��1.8��2.6��10��3mol?L��1
��5���л���ȡ��������
���������⣺VOSO4�к���K2SO4��SiO2���ʣ��������費����ˮ����ˮ�ܹ��˵õ�����VO2����SO42����K+��Һ������Ϊ�������裬����Һ�м����л���ȡ����ȡ��Һ��VO2�� �� ͨ����Һ�õ�����VO2�����л��㣬�����Լ�X���з���ȡ����ϣ�2���в���ڡ��۵ı仯Ϊ������̣���֪XΪ���ᣬ���������Һ�õ��л����ˮ�㣬�ɼ��백ˮ����pH�õ��ij�������֪����������KClO3����VO2��ΪVO3�� �� ��ϣ�4���еõ��������ʺ���ҺpH֮���ϵ����֪pHӦ������1.7��1.8�����NH4VO3�ֽ�õ�������V2O5 �� �ɹ������̿�֪���������л��ܼ�����ѭ�����ã���1������K2SO4��SiO2���ʵ�VOSO4ˮ�ܺ������費����ˮ������I�Ƿ��뻥�����ܵĹ�����Һ̬��Ӧ��ȡ���˲������õ�����Ϊ�������裬���Դ��ǣ�SiO2�����ˣ���2��������ȡʱ��������������Rn+��ˮ�㣩+nHA���л��㣩RAn���л��㣩+nH+��ˮ�㣩����֪����ļ���ƽ���е������ӷ�Ӧ���ٽ�ƽ��������У�����˷�����ȡ�ʣ����з���ȡʱ�����X�Լ�������ƽ��������У����Լ�����������ƽ��������У����Դ��ǣ�������кͲ������ᣬƽ����������˷�����ȡ�ʣ������3��KClO3����VO2��ΪVO3�� �� ClO3������ԭΪCl�� �� ��ƽ�����ӷ���ʽΪ��ClO3��+6VO2++9H2O=Cl��+6VO3��+18H+ �� ���Դ��ǣ�ClO3��+6VO2++9H2O=Cl��+6VO3��+18H+����4�����ݱ��������жϣ����м��백ˮ��������ҺpH���ֵΪ1.7��1.8����ʱ�������ʴﵽ�������������Ϊ93.1%ʱ������Fe��OH��3��������ʱpH=2��c��H+��=10��2mol/L����c��OH����=10��12mol/L����Ksp[Fe��OH��3]=c��Fe3+����c3��OH����=2.6��10��39 �� �ɵ�c��Fe3+��=2.6��10��3molL��1������Fe��OH��3����������Һ��c��Fe3+����2.6��10��3molL��1 �� ���Դ��ǣ�1.7��1.8��2.6��10��3molL��1����5���ɹ�ҵ����ͼ��֪���������л���ȡ������������ѭ�����ã����Դ��ǣ��л���ȡ����������

 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�����Ŀ����֤�������д��ڵ�Ԫ�ص�ʵ������У���Ҫ����ѡ�ô�����ǣ� ��
ѡ�� | ���� | ��Ҫ���� |
A | ��ȡ3.0g�ɺ��� | ������ƽ |
B | ���ոɺ�������ȫ��ɻҽ� | ������ |
C | ������к�ĺ�������ˮ�Ļ��Һ | ©�� |
D | �����Ȼ�̼��������ĺ����ҽ�ȡҺ����ȡ�� | ��Һ©�� |
A.AB.BC.CD.D
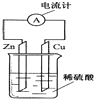
����Ŀ��Ϊ��ǿ������ʴ�ԣ�����Ǧ����Ϊ���Դ����Al��������Pb�����������ϡ���ᣬʹ�����������Ĥ�����䷴Ӧԭ�����£���أ�Pb��s��+PbO2��s��+2H2SO4��aq��=2PbSO4��s��+2H2O��l�������أ�2Al+3H2O ![]() Al2O3+3H2�����������У������ж���ȷ���ǣ� ��
Al2O3+3H2�����������У������ж���ȷ���ǣ� ��
��� | ���� | |
A | H+����Pb�缫 | H+����Pb�缫 |
B | ÿ����3molPb | ����2molAl2O3 |
C | ������PbO2+4H++2e��=Pb2++2H2O | ������2Al+3H2O��6e��=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D