题目内容
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)=CO2(g)△H1;C(s)+ ![]() O2(g)=CO(g)△H2
O2(g)=CO(g)△H2
②S(s)+O2(g)=SO2(g)△H3;S(g)+O2(g)=SO2(g)△H4
③H2(g)+ ![]() O2(g)=H2O(l)△H5;2H2(g)+O2(g)=2H2O(l)△H6
O2(g)=H2O(l)△H5;2H2(g)+O2(g)=2H2O(l)△H6
④CaCO3(s)=CaO(s)+CO2(g)△H7;CaO(s)+H2O(l)=Ca(OH)2(s)△H8 .
A.②③④
B.④
C.①
D.①②③
【答案】A
【解析】解:①两个反应都为放热反应,△H<0,前者完全反应,放出的热量多,则△H1<△H2 , 故①错误;②都为放热反应,其△H<0,前者S为固态,则前者放出的热量少,则△H3>△H4 , 故②正确;③都是放热反应,前者反应物系数较小,则前者放出热量较少,则△H5>△H6 , 故③正确;④前者为吸热反应,△H7>0,后者为放热反应,△H8<0,则△H7>△H8 , 故④正确;根据分析可知,反应的△H前者大于后者的是②③④,
故选A.
【考点精析】掌握反应热和焓变是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: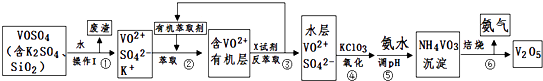
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)④的离子方程式为 .
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 . 若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< . (已知:25℃时,Ksp[Fe(OH)3]=2.6×10﹣39)
(5)该工艺流程中,可以循环利用的物质有和 .
