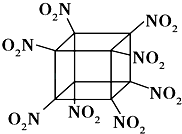
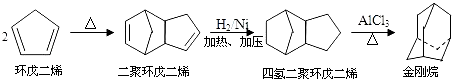
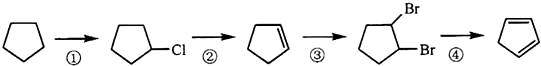
题目内容
【题目】如图是铜锌原电池的装置示意图.回答下列问题: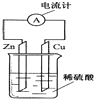
(1)原电池是将能转化成能的装置.
(2)在导线中电子流动的方向是;其中正极为 , 正极上能观察到的现象是 .
(3)原电池能产生电流的本质原因是(选填编号).a.有两个活泼性不同的电极 b.有自由移动的离子
c.发生了氧化还原反应 d.形成了闭合回路.
【答案】
(1)化学;电
(2)从负极流向正极;铜片;铜片上有气泡冒出
(3)c
【解析】解:(1)原电池是将化学能转化为电能的装置,所以答案是:化学;电;(2)在导线中电子流动的方向是从负极流向正极(或从锌片流向铜片);铜片为正极,铜片上氢离子放电产生气泡,所以答案是:从负极流向正极(或从锌片流向铜片);铜片;铜片上有气泡冒出;(3)原电池中,外电路中,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极;内电路中,电解质溶液中的阴离子向负极移动,阳离子向正极移动,所以形成了闭合回路,产生了电流,所以电极上进行的氧化还原反应中发生了电子的转移是原电池产生电流的本质原因.故选c.

 阅读快车系列答案
阅读快车系列答案【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: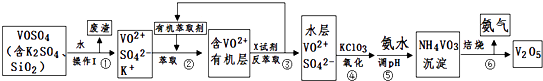
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)④的离子方程式为 .
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 . 若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< . (已知:25℃时,Ksp[Fe(OH)3]=2.6×10﹣39)
(5)该工艺流程中,可以循环利用的物质有和 .
【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,则现象及结论都正确的是( )
操作 | 现象 | 结论 | |
A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42﹣ |
B | 滴加氯水和CCl4 , 振荡、静置 | 上层溶液显橙红色 | 原溶液中有Br﹣ |
C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈紫色 | 原溶液中有K+ |
D | 滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
A.A
B.B
C.C
D.D