题目内容
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是
的物质的量随时间变化的曲线如图所示。下列判断正确的是

A. 该反应的氧化剂ClO-,还原产物是![]() B. 消耗1mol还原剂,转移6mol电子
B. 消耗1mol还原剂,转移6mol电子
C. 水是生成物,且反应后溶液的酸性明显增强 D. 氧化剂与还原剂的物质的量之比为2:3
【答案】C
【解析】
N2物质的量随着时间的推移逐渐增大,N2为生成物,根据N守恒,NH4+为反应物,NH4+被氧化成N2,则ClO-被还原成Cl-,用化合价升降法配平,得出反应的离子方程式为:2NH4++3ClO-=N2↑+3Cl-+2H++3H2O。
N2物质的量随着时间的推移逐渐增大,N2为生成物,根据N守恒,NH4+为反应物,NH4+被氧化成N2,则ClO-被还原成Cl-。
A项,根据上述分析,该反应的氧化剂是ClO-,还原产物是Cl-,N2是氧化产物,A项错误;
B项,该反应中还原剂为NH4+,反应中N元素的化合价由-3价升高至0价,消耗1mol还原剂NH4+,转移3mol电子,B项错误;
C项,在反应中N元素的化合价由-3价升至0价,Cl元素的化合价由+1价降至-1价,根据得失电子守恒、原子守恒和电荷守恒,反应的离子方程式为:2NH4++3ClO-=N2↑+3Cl-+2H++3H2O,反应生成H2O和H+,水是生成物,且反应后溶液的酸性明显增强,C项正确;
D项,1mol氧化剂ClO-得到2mol电子,1mol还原剂NH4+失去3mol电子,根据得失电子总数相等,氧化剂与还原剂物质的量之比为3:2,D项错误;
答案选C。

【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
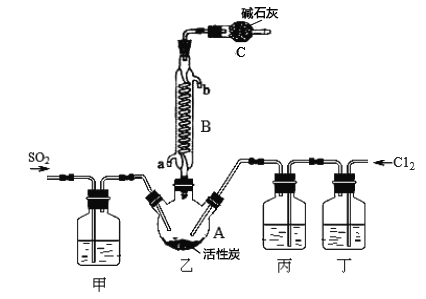
(1)写出浓盐酸和氯酸钾反应制取Cl2的离子方程式_________________。
(2)丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。