题目内容
【题目】如下表是元素周期表的短周期,请根据表中的位置,按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用元素符号填空:在这十种元素中,化学性质最稳定的是_____,通常情况下化合价只有负价而无正价的是______,原子半径最小的是_______,原子半径最大的主族元素是_________。
(2)用化学式填空:在这十种元素中,最高价氧化物的水化物碱性最强的是______,酸性最强是________,呈两性的是_________。
(3)①和②形成的最简单的化合物的结构式是_____________。
(4)元素③的气态氢化物的电子式是________________。
(5)③可以形成多种氧化物,其中一种是红棕色气体,试用化学方程式说明该气体不宜采用排水法收集的原因__________________________。
【答案】Ar F H Na NaOH HClO4 Al(OH)3 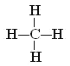
![]() 3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
【解析】
根据元素在周期表中的位置知,①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩分别是H、C、N、F、Na、Al、P、S、Cl、Ar元素,以此分析解答。
(1)稀有气体元素化学性质最不活泼,所以化学性质最不活泼的是Ar;F元素没有正化合价,所以通常情况下化合价只有负价而无正价的是F元素;原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以这几种元素中原子半径最小的是H,原子半径最大的主族元素是Na,
因此,本题正确答案是:Ar ;F ;H ;Na;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强,所以碱性最强的是NaOH,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以酸性最强的是HClO4,Al(OH)3呈两性,
因此,本题正确答案是:NaOH ;HClO4 ;Al(OH)3;
(3) ①和②形成的最简单有机化合物为甲烷,甲烷为正四面体结构,甲烷的结构式为: ,
,
因此,本题正确答案是:  ;
;
(4) 元素③的气态氢化物为NH3,其电子式为:![]() ,
,
因此,本题正确答案是: ![]() ;
;
(5)③可以形成多种氧化物,其中一种红棕色气体为NO2,二氧化氮和水反应生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO,
因此,本题正确答案是:3NO2+H2O=2HNO3+NO。

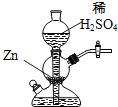
【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
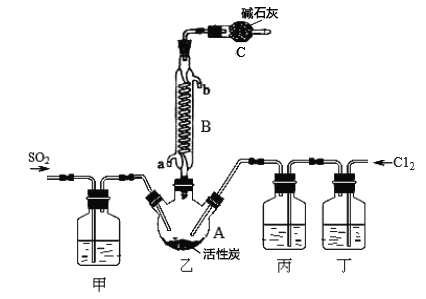
(1)写出浓盐酸和氯酸钾反应制取Cl2的离子方程式_________________。
(2)丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。
【题目】环己酮是一种重要的有机化工原料。实验室合成环己酮的反应如下:
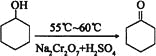
环己醇和环己酮的部分物理性质见下表:
物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm—3、20 ℃) | 溶解性 |
环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是 。
(2)b中水层用乙醚萃取的目的是 。
(3)以下关于萃取分液操作的叙述中,不正确的是 。
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图( )用力振荡
)用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是 。蒸馏除乙醚的操作中,采用的加热方式为 。
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 。
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是 (保留两位有效数字)。