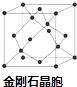
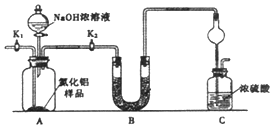
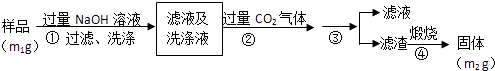
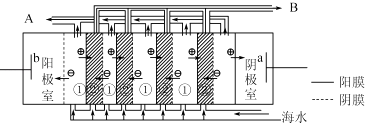
题目内容
【题目】硫单质及其化合物在工农业生产中有着重要的应用,请回答下列问题: 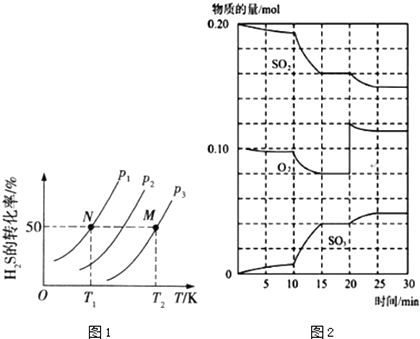
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下: ①CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g)△=+210.5kJmol﹣1
② ![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g) ![]() CaS(s)+CO2(g)△=﹣47.3kJmol﹣1
CaS(s)+CO2(g)△=﹣47.3kJmol﹣1
反应:CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g)△H=kJmol﹣1
平衡常数K的表达式为 .
(2)图1为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系. 图1中压强P1、P2、P3的大小顺序为 , 理由是 , 该反应平衡常数的大小关系为K(T1)K(T2)(“>”“=”或“<”),理由是
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)2SO3△H<0 ①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段所示
②据图2判断,反应进行至20min时,曲线发生变化的原因是(用文字表达):10min到15min的曲线变化的原因可能是(填写编号)
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO2的物质的量
(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示)
【答案】
(1)﹣399.7;![]()
(2)P1<P2<P3;反应前后气体体积增大,增大压强,平衡逆向进行;<;反应是吸热反应,升温,平衡正向进行,平衡常数增大
(3)15﹣20min和25﹣30min;增大氧气的浓度;AB
(4)2c(SO32﹣)+c(HSO3﹣)
【解析】解:(1)(1)①CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g)△=+210.5kJmol﹣1② ![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g) ![]() CaS(s)+CO2(g)△=﹣47.3kJmol﹣1
CaS(s)+CO2(g)△=﹣47.3kJmol﹣1
结合盖斯定律可知,②×4﹣①得到CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g),
则△H=(﹣47.3kJmol﹣1)×4﹣(+210.5kJmol﹣1)=﹣399.7kJ/mol;
K= ![]() ,
,
所以答案是:﹣399.7; ![]() ;(2)图1中压强P1、P2、P3的大小顺序为P1<P2<P3;理由是反应前后气体体积增大,增大压强,平衡逆向进行;由图可知,温度越高,转化率越大,则该反应为吸热反应,升高温度,K增大,即K(T1)<K(T2),
;(2)图1中压强P1、P2、P3的大小顺序为P1<P2<P3;理由是反应前后气体体积增大,增大压强,平衡逆向进行;由图可知,温度越高,转化率越大,则该反应为吸热反应,升高温度,K增大,即K(T1)<K(T2),
所以答案是:P1<P2<P3;反应前后气体体积增大,增大压强,平衡逆向进行;<;反应是吸热反应,升温,平衡正向进行,平衡常数增大;(3)①平衡时物质的量不变,则反应处于平衡状态的15﹣20min和25﹣30min时间段所示,所以答案是:15﹣20min和25﹣30min;
②反应进行至20min时,氧气的浓度瞬间增大,则曲线发生变化的原因是增大氧气的浓度;10min到15min的曲线斜率增大,反应速率加快,反应物浓度减小,加催化剂、缩小体积均符合,C中降低温度,反应速率减小,D中二氧化硫浓度增大,故选AB,
所以答案是:增大氧气的浓度;AB;(4)得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,存在c(H+)=c(OH﹣),c(Na+)+c(H+)=c(OH﹣)+2c(SO32﹣)+c(HSO3﹣),则c(Na+)=2c(SO32﹣)+c(HSO3﹣),所以答案是:2c(SO32﹣)+c(HSO3﹣).
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案