题目内容
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如图1所示. 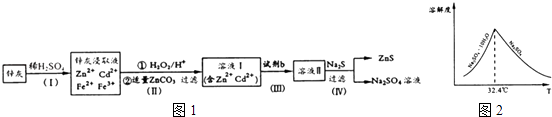
(1)为提高锌灰的浸取率,可采用的方法是(填序号).
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是(写化学式).
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S.
①检验ZnS固体是否洗涤干净的方法是 ,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取.化学反应方程式为
③已知Na2SO4 . 10H2O及Na2SO4的溶解度随温度变化曲线如图2.从滤液中得到Na2SO4.10H2O的操作方法是
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL,物质的量浓度为c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为 .
【答案】
(1)①②③⑤
(2)Fe(OH)3
(3)Zn(或锌)
(4)取最后一次洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净;Na2S04+CH4 ![]() Na2S+2H2O+CO2;蒸发浓缩,降温结晶,过滤
Na2S+2H2O+CO2;蒸发浓缩,降温结晶,过滤
(5)65(Vc﹣b﹣d)g
【解析】解:锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的滤液Ⅰ,和滤渣为Fe(OH)3 , 步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌,(1)搅拌、适当升温、将废渣碾细成粉末、搅拌、多次浸取等都可提高锌灰的浸取率,故选①②③⑤;(2)根据上面的分析可知,步骤Ⅱ所得滤渣中的物质是Fe(OH)3 ,
所以答案是:Fe(OH)3;(3)根据上面的分析可知,试剂b应为锌,
所以答案是:Zn(或锌);(4)①ZnS固体是从硫酸钠溶液中析出的,所以检验ZnS固体是否洗涤干净的方法是取最后一次洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净,
所以答案是:取最后一次洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净;②等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒可知,该化学反应方程式为Na2S04+CH4 ![]() Na2S+2H2O+CO2 ,
Na2S+2H2O+CO2 ,
所以答案是:Na2S04+CH4 ![]() Na2S+2H2O+CO2;③根据溶解度随温度变化曲线可知,从滤液中得到Na2SO4.10H2O的操作方法是蒸发浓缩,降温结晶,过滤,
Na2S+2H2O+CO2;③根据溶解度随温度变化曲线可知,从滤液中得到Na2SO4.10H2O的操作方法是蒸发浓缩,降温结晶,过滤,
所以答案是:蒸发浓缩,降温结晶,过滤; (5)步骤Ⅲ所得Cd为d mol,则用于置换镉的锌的物质的量为d mol,硫酸钠的物质的量为VL×c mol/L=cVmol,所以硫酸锌的物质的量为cVmol,根据锌元素守恒可知,样品中锌元素的物质的量为cVmol﹣d mol﹣b mol,所以锌灰中含有锌元素的质量为65g/mol×(cVmol﹣d mol﹣b mol)=65(Vc﹣b﹣d)g,
所以答案是:65(Vc﹣b﹣d)g.

【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: 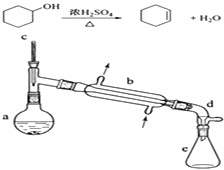
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是 .
(2)加入碎瓷片的作用是;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并;在本实验分离过程中,产物应该从分液漏斗的(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是 .
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有 ABE (填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验所得到的环己烯产率是 . (保留两位有效数字)
(注:产率= ![]() ×100%)
×100%)