��Ŀ����
����Ŀ��A��B��C��D��EΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ����вⶨ�������������� B��Aͬ���ڣ���s�ܼ���������p�ܼ��������ࣻCԭ�ӵ������������Ǵ�����3����D��Bͬ���壻E��ԭ������Ϊ29���ش��������⣺
��1������Ԫ���е�һ����������������Ԫ�ط��ţ�������Dԭ�Ӽ۵����Ų�ͼΪ ��
��2��Ԫ��B�ļ���̬�⻯��ķе�����ڡ����ڡ���Ԫ��A�ļ���̬�⻯��ķе㣬����Ҫԭ������ A�ļ���̬�⻯������ԭ�ӵ��ӻ��������Ϊ ��
��3��BC3�������幹��Ϊ �� ���以Ϊ�ȵ�����ķ�������д��ѧʽ����
��4��EC�ڼ�������������ת��ΪE2C����ԭ�ӽṹ�ĽǶȽ���ԭ����Eԭ�ӵ���Χ�����Ų�ʽΪ �� E����Ķѻ���ʽΪ������ţ� �ټ������ѻ� �����������ѻ�
���������ܶѻ� �������������ܶѻ�
��5������D���γ�һ����ĥ����F����ṹ����ʯ���ƣ���ͼ��������������廯���D�����廯���ڸ������������ķ�Χ�кϳɣ�д���ϳ�F�Ļ�ѧ����ʽ�� �� F�ľ����߳�Ϊa pm����þ����ܶȵı���ʽΪgcm��3 �� ���ú�a��NA��ʽ�ӱ�ʾ�����ػ��� 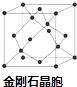
���𰸡�
��1��N��![]()
��2�����ڣ�NH3����֮����������sp3
��3��ƽ�������Σ�SO3
��4��Cu2+������Χ�����Ų�Ϊ3d9 �� ��Cu+������Χ�����Ų�Ϊ3d10 �� Ϊȫ���ȶ�״̬��Cu2O���ȶ���3d104s1����
��5��BBr3+PBr3+3H2 ![]() ?BP+6HBr��
?BP+6HBr��![]()
���������⣺A��B��C��D��EΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ����вⶨ����������������AΪ̼Ԫ�أ� B��Aͬ���ڣ���s�ܼ���������p�ܼ��������࣬ԭ�Ӻ���������Ų�ʽΪ1s22s22p3 �� ��BΪNԪ�أ�Cԭ�ӵ������������Ǵ�����3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����CΪOԪ�أ�D��Bͬ���壬��DΪPԪ�أ�E��ԭ������Ϊ29����EΪCu����1.���ǽ�����Խǿ��һ������Խ��NԪ��ԭ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�صģ���NԪ�صĵ�һ���������
DΪPԪ�أ�ԭ�Ӽ۵����Ų�ʽΪ3s23p3 �� ԭ�Ӽ۵����Ų�ͼΪ ![]() ��
��
���Դ��ǣ�N�� ![]() ��
��
��2.��Ԫ��A��B�ļ���̬�⻯��ֱ�ΪCH4��NH3 �� NH3����֮�����������е���ڼ���ģ����������Cԭ���γ�4��C��H����û�й¶Ե��ӣ���̼ԭ�Ӳ�ȡsp3�ӻ���
���Դ��ǣ����ڣ�NH3����֮����������sp3��
��3.��NO3����Nԭ�ӹµ��Ӷ���= ![]() =0���۲���Ӷ���=3+0=3�����幹��Ϊƽ�������Σ����以Ϊ�ȵ�����ķ�����SO3 ��
=0���۲���Ӷ���=3+0=3�����幹��Ϊƽ�������Σ����以Ϊ�ȵ�����ķ�����SO3 ��
���Դ��ǣ�ƽ�������Σ�SO3��
��4.��Cu2+������Χ�����Ų�Ϊ3d9 �� ��Cu+������Χ�����Ų�Ϊ3d10 �� Ϊȫ���ȶ�״̬��Cu2O���ȶ���CuO�ڼ�������������ת��ΪCu2O��
Cuԭ�ӵ���Χ�����Ų�ʽΪ��3d104s1 �� Cu����Ķѻ���ʽΪ�����������ܶѻ���
���Դ��ǣ�Cu2+������Χ�����Ų�Ϊ3d9 �� ��Cu+������Χ�����Ų�Ϊ3d10 �� Ϊȫ���ȶ�״̬��Cu2O���ȶ���3d104s1���ܣ�
��5.������P���γ�һ����ĥ����F����ṹ����ʯ���ƣ���ͼ������FΪBP������������廯���D�����廯���ڸ������������ķ�Χ�кϳɣ��ϳ�F�Ļ�ѧ����ʽ��BBr3+PBr3+3H2 ![]() BP+6HBr��
BP+6HBr��
���ʯ������Cԭ����ĿΪ4+8�� ![]() +6��
+6�� ![]() =8������B��Pԭ����Ŀ��Ϊ4����������Ϊ4��
=8������B��Pԭ����Ŀ��Ϊ4����������Ϊ4�� ![]() g�������߳�Ϊa pm����þ����ܶ�Ϊ4��
g�������߳�Ϊa pm����þ����ܶ�Ϊ4�� ![]() g�£�a��10��10 cm��3=
g�£�a��10��10 cm��3= ![]() gcm��3 ��
gcm��3 ��
���Դ��ǣ�BBr3+PBr3+3H2 ![]() BP+6HBr��
BP+6HBr�� ![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����CH3CH2CH2Br�Ʊ�CH3CH��OH��CH2OH�����Σ��������ң�������Ӧ�����ͺ���������ȷ���ǣ� ��
ѡ�� | ��Ӧ���� | ��Ӧ���� |
A | �ӳɷ�Ӧ��ȡ����Ӧ����ȥ��Ӧ | KOH����Һ/���ȡ�KOHˮ��Һ/���ȡ����� |
B | ��ȥ��Ӧ���ӳɷ�Ӧ��ȡ����Ӧ | NaOH����Һ/���ȡ����¡�NaOHˮ��Һ/���� |
C | ������Ӧ��ȡ����Ӧ����ȥ��Ӧ | ���ȡ�KOH����Һ/���ȡ�KOHˮ��Һ/���� |
D | ��ȥ��Ӧ���ӳɷ�Ӧ��ˮ�ⷴӦ | NaOHˮ��Һ/���ȡ����¡�NaOH����Һ/���� |
A.A
B.B
C.C
D.D