题目内容
【题目】Na2S2O5可用作食品的抗氧化剂。为测定某葡萄酒中Na2S2O5残留量,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘的水溶液与其反应,恰好消耗10.00 mL。下列说法正确的是( )
A.反应的离子方程式为:S2O52- + I2 + 3H2O = 2SO42- + 2I-+ 6H+
B.该反应转移电子数为1×10-3NA
C.该样品中Na2S2O5的残留量,若以SO2计为0.128 g·L1
D.反应结束后,所得溶液的pH比原溶液增大
【答案】C
【解析】
A.Na2S2O5可用作食品的抗氧化剂,说明Na2S2O5具有一定的还原性,能被碘标准液滴定,说明发生氧化还原反应产生Na2SO4,I2被还原为I-,则发生滴定反应的离子方程式为:S2O52-+2I2+3H2O═2SO42-+4I-+6H+,故A错误;
B.10.00 mL 0.01000 mol·L1的碘的水溶液中I2的物质的量为0.01L× 0.01000 mol·L1=1× 10 -4mol,在S2O52-+2I2+3H2O═2SO42-+4I-+6H+中I元素从0价降为-1价,则该反应转移电子数为2×10-4NA,故B错误;
C.根据S2O52-+2I2+3H2O═2SO42-+4I-+6H+可知Na2S2O5的物质的量为0.5× 10 -4mol,若以SO2计应为![]() =0.128 g·L1,故C正确;
=0.128 g·L1,故C正确;
D.由S2O52-+2I2+3H2O═2SO42-+4I-+6H+可知,反应后所得溶液的pH比原溶液减小,故D错误;
故答案为B。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
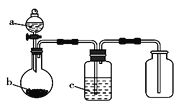
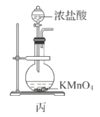
双基同步导航训练系列答案【题目】利用如图装置制取下表中的四种气体(图中夹持仪器已略去;a、b、c表示相应仪器中加入的试剂),能达到实验目的的是( )
选项 | 气体 | a | b | c |
|
A | H2 | 稀硫酸 | Zn | 浓硫酸 | |
B | CO2 | 盐酸 | CaCO3 | 饱和碳酸氢钠溶液 | |
C | NH3 | 浓氨水 | CaO | 浓硫酸 | |
D | Cl2 | 浓盐酸 | MnO2 | 饱和食盐水 |
A.AB.BC.CD.D