题目内容
【题目】(1)物质的量相等的 CO 和 CO2 中,同温同压下所占的体积比为____,原子个数之比为______;
(2)1.8g水与_______mol硫酸所含的分子数相等,它们所含氧原子数之比是________,其中氢原子数之比是___________。
(3)3.2g某气体中含有的分子数约为3.01×1022,此气体的摩尔质量为________。
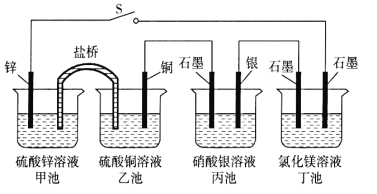
(4)可用于分离或提纯物质的方法有:
A 过滤 B 萃取 C 渗析 D 蒸馏 E 灼热氧化 F 分液.
如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
①除去淀粉溶液中的少量碘化钠________; ②提取溴水中的溴单质______;
③除去水中的Na+、![]() 、Cl-等杂质________; ④除去CuO中的Cu ______;
、Cl-等杂质________; ④除去CuO中的Cu ______;
【答案】1:1 2:3 0.1 1:4 1:1 64g/mol C B/BF D E
【解析】
(1)同温同压下,气体的物质的量之比等于体积之比,原子的物质的量等于分子的物质的量乘以分子中原子的个数;
(2)1.8g水所含分子的数目用公式N=n×NA= ![]() ;
;
(3)利用n=![]() =
=![]() ,从而计算出M;
,从而计算出M;
(4)选择分离物质的方法时,要考虑物质的性质,除去淀粉溶液中的少量碘化钠,选择渗析,淀粉溶液属于胶体,碘化钾溶在溶液里,区分溶液和胶体的方法是渗析;溴水中的溴用有机溶剂萃取后分液;除去自来水中可溶性的离子,可用蒸馏,CuO中的Cu可用加热氧化的方式把铜氧化成氧化铜。
(1)根据阿伏伽德罗定律,在相同的温度和压强下,相同体积的任何气体含有相同数目的分子。物质的量相等的 CO和 CO2,分子的数目也相同,故体积也相同,故体积比为1:1。一个CO分子中含有两个原子,CO2分子中含有三个原子,分子的数目相同,故原子数目比为2:3,
故答案为:1:1;2:3;
(2)1.8g水中水分子的数目=![]() =
=![]() ×NA =0.1 NA个,0.1 NA个硫酸分子的物质的量为0.1mol,由于分子数相同,一个水分子含有一个氧原子,一个硫酸分子含有四个氧原子,故氧原子的数目比为1:4 ,一个水分子有两个氢原子,一个硫酸分子也有两个氢原子,其中氢原子数之比是1:1,
×NA =0.1 NA个,0.1 NA个硫酸分子的物质的量为0.1mol,由于分子数相同,一个水分子含有一个氧原子,一个硫酸分子含有四个氧原子,故氧原子的数目比为1:4 ,一个水分子有两个氢原子,一个硫酸分子也有两个氢原子,其中氢原子数之比是1:1,
故答案为:0.1;1:4;1:1;
(3)3.2g某气体中含有的分子数约为3.01×1022 利用n=![]() =
=![]() ,从而计算出M=
,从而计算出M=![]() =
=![]() =
=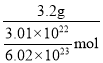 = 64g/mol,
= 64g/mol,
故答案为:64g/mol;
(4)A.过滤是使液固或气固混合物中的流体强制通过多孔性过滤介质,将其中的悬浮固体颗粒加以截留,从而实现混合物的分离操作。
B.萃取是利用化合物在两种互不相溶(或微溶)的溶剂中溶解度的不同,使化合物从一种溶剂内转移到另外一种溶剂中而提取出来的过程,萃取之后要分液。
C.渗析是一种以浓度差为推动力的膜分离操作,利用膜对溶质的选择透过性,实现不同性质溶质的分离,可用于分离溶液和胶体。
D.蒸馏是一种热力学的分离工艺,它利用混合液体或液-固体系中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分的单元操作过程,是蒸发和冷凝两种单元操作的联合。①除去淀粉溶液中的少量碘化钠可选择渗析,
②提取溴水中的溴单质,可以选用萃取和分液操作;
③除去水中的Na+、![]() 、Cl-等杂质,选择蒸馏;
、Cl-等杂质,选择蒸馏;
④除去CuO中的Cu,可选择灼热氧化;
故答案为:C; B/BF;D;E。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】利用苯甲醛(C6H5CHO)在NaOH溶液中可以制苯甲醇(C6H5CH2OH)和苯甲酸(C6H5COOH)。实验流程如图:

相关物质的性质如下表所示。回答下列问题:
物质 | 对水的相对密度 | 沸点 | 溶解性 |
苯甲醇 | 1.04 | 205.7 | 微溶于水,易溶于乙醚 |
苯甲酸 | 1.27 | 249 | 微溶于冷水,可溶于热水,易溶于乙醚 |
乙醚 | 0.71 | 34.6 | 与水互不相溶 |
(1)操作①中,需要用到的玻璃仪器除烧杯外,还有____。操作①后,苯甲醇在容器中混合物的_____(填“上”或“下”)层。
(2)乙醚层用10%Na2CO3溶液洗涤的目的是_____。操作②前常需要加入MgSO4,作用是______。操作②的装置如图,指出该装置图中两个错误:______。

(3)操作③是______,操作④是______。
(4)取106.00g苯甲醛反应,若苯甲醛的转化率为80%,乙醚的萃取率为100%,洗涤等过程损失率为10%,则最终可制得苯甲醇___g(结果保留小数点后两位)。