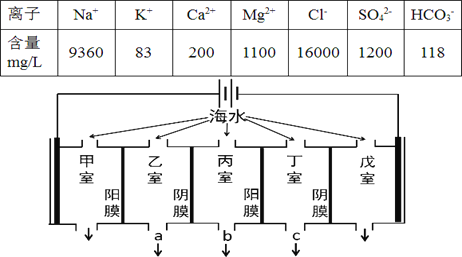
题目内容
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
【答案】C
【解析】氢氧化钠溶液的作用是吸收多余的酸性气体,避免污染空气,选项A正确。硫酸亚铁受热分解,产生的红色固体一定含有Fe元素,所以可能是Fe2O3,选项B正确。如果二氧化硫气体,通入硝酸钡溶液中,因为二氧化硫溶于水溶液显酸性,酸性条件下,硝酸根离子将二氧化硫氧化为硫酸,再与钡离子生成硫酸钡沉淀。所以用硝酸钡溶液的问题是:无法判断使硝酸钡溶液出现白色沉淀的是二氧化硫还是三氧化硫,选项C错误。实验后反应管中残留固体为红色粉末(Fe2O3),BaCl2溶液中有白色沉淀产生(说明有SO3),品红溶液中红色褪去(说明有SO2),检查氢氧化钠溶液出口处无氧气产生,所以分解的方程式为:2FeSO4 ![]() Fe2O3 + SO3↑+ SO2↑,所以氧化产物(Fe2O3)和还原产物(SO2)物质的量之比为1:1,选项D正确。
Fe2O3 + SO3↑+ SO2↑,所以氧化产物(Fe2O3)和还原产物(SO2)物质的量之比为1:1,选项D正确。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】化学学习小组在实验室中对铁盐与亚铁盐的相互转化进行如下探究。
已知:SCN-具有强还原性,易被氧化为(SCN)2。
实验Ⅰ:Fe3+转化为Fe2+
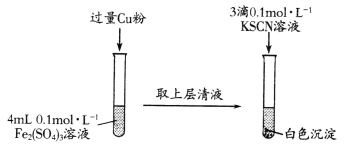
(1)Fe2(SO4)3溶液与Cu粉发生反应的离子方程式为________________________。
(2)探究白色沉淀产生的原因:
①提出假设:
假设1:白色沉淀是Fe2+与SCN-直接结合所得;
假设2:白色沉淀是Cu2+与SCN-直接结合所得;
假设3:_____________________________________________。
②实验验证:
向CuSO4溶液中通人过量SO2,将Cu2+还原,再加入KSCN溶液,观察到有白色沉淀生成,证明假设三成立。写出CuSO4溶液与KSCN溶液反应的离子方程式:________。
实验Ⅱ:Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol·L-1 FeSO4溶液中加入3mL 4mol·L-1稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
(3)实验Ⅱ中,Fe2+转化为Fe3+的离子方程式是_____________________________。
(4)设计如下实验,探究溶液变为棕色的原因:
①向Fe2(SO4)3溶液中通入NO,溶液颜色无变化
②向FeSO4溶液中通入NO,溶液颜色变为棕色
③向Fe(NO3)3溶液中通入NO,溶液颜色无变化
由上述实验分析溶液变为棕色的原因是_________________________________________。