题目内容
【题目】某温下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A. 增大c(A)、c(B),K增大
B. 降低温度,正反应速率增大
C. 该反应的焓变为负值
D. 该反应的化学方程式为2E(g)+F(g)![]() A(g)+2B(g)
A(g)+2B(g)
【答案】D
【解析】某温度下气体反应达到化学平衡,平衡常数K=![]() ,则该反应为2E(g)+F(g)A(g)+2B(g),恒容时,若温度适当降低,F的浓度增加,平衡向正反应方向移动,正反应为吸热反应。A.平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变,故A错误;B.降低温度,正、逆反应速率都降低,逆反应速率降低更多,平衡向正反应方向移动,故B错误;C.正反应为吸热反应,焓变为正值,故C错误;D.平衡常数K=
,则该反应为2E(g)+F(g)A(g)+2B(g),恒容时,若温度适当降低,F的浓度增加,平衡向正反应方向移动,正反应为吸热反应。A.平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变,故A错误;B.降低温度,正、逆反应速率都降低,逆反应速率降低更多,平衡向正反应方向移动,故B错误;C.正反应为吸热反应,焓变为正值,故C错误;D.平衡常数K=![]() ,则该反应为2E(g)+F(g)A(g)+2B(g),故D正确;故选D。
,则该反应为2E(g)+F(g)A(g)+2B(g),故D正确;故选D。

【题目】滴定是一种重要的定量实验方法:
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:
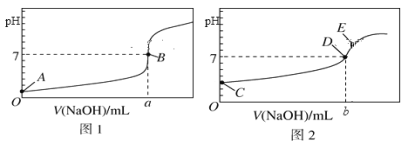
(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________(电离度=![]() ×100%)。
×100%)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________mol/L。
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当___________________时,停止滴定,并记录NaOH溶液的最终读数。
⑤重复②、③、④步骤3次。
数据记录如下:
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为_________ mol/L
(3)误差在本实验的滴定过程中,下列操作会使实验结果偏大的是_________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前平视读数,滴定后俯视读数