题目内容
15.(1)了解用药常识,有利于自我保健.现有下列药物:A、麻黄碱 B、抗酸药(氢氧化铝) C、青霉素 D、阿司匹林(乙酰水杨酸)
①治疗胃酸过多,但患有严重的胃溃疡,应该选择B.
②可治疗支气管哮喘,但不宜过多服用的药物是A.Ⅱ
③一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是C.
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是D.
分析 麻黄碱具有止咳平喘的作用,可用于治疗支气管哮喘,过量服用会产生失眠等副作用;
抗酸药的种类很多,通常含有一种或几种能中和盐酸的化学物质如氢氧化铝;
青霉素是最早发现的对许多病原菌有抑制作用,对人和动物组织无毒的抗生素;
阿司匹林是一种既能解热,又能镇痛,还有消炎、抗风湿作用的药物.
解答 解:①治疗胃酸过多,但患有严重的胃溃疡,应该选择抗酸药(氢氧化铝),故答案为:B;
②可治疗支气管哮喘,但不宜过多服用的药物是麻黄碱,故答案为:A;
③是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是青霉素,故答案为:C;
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是阿司匹林,故答案为:D.
点评 本题考查了药物的使用,明确常见药物的用途及注意事项,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
5. 纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:
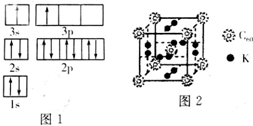
(1)某同学根据上述信息,推断B的核外电子排布如图1所示.该同学所画的电子排布图违背了能量最低原理.
(2)ACl2分子中A的杂化类型为sp杂化.
(3)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.基态钾原子的价电子排布式为4S1,该物质中K原子和C60分子的个数比为3:1.
(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的价层电子对互斥理论模型为正四面体.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则分子中π键的数目为30.
 纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(KJ•mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1541 | 7733 | 10540 |
(2)ACl2分子中A的杂化类型为sp杂化.
(3)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.基态钾原子的价电子排布式为4S1,该物质中K原子和C60分子的个数比为3:1.
(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的价层电子对互斥理论模型为正四面体.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则分子中π键的数目为30.
20.下列物质间的反应,其能量变化符合下图的是( )
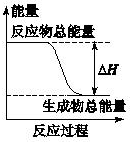

| A. | 由Zn和稀H2SO4反应制取氢气 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | D. | 碳酸钙的分解 |
7.(1)人们常用催化剂来选择反应进行的方向.如图1所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
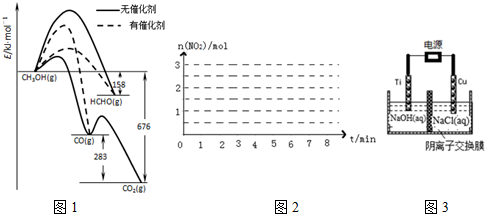
①写出1moL HCHO生成CO的热化学方程式:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-235KJ•mol-1.
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能.
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g)?3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是abd.
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与NO2体积比保持不变
d.体系压强保持不变
②在某温度下,5L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
请画出该反应中n(NO2)随时间变化曲线,并画出在第7min分别升温、加压、加催化剂的情况下n(NO2)随时间变化示意图如图2.计算该温度下反应的平衡常数K(保留2位有效数字,写出计算过程).
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,如图3所示.该电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.

①写出1moL HCHO生成CO的热化学方程式:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-235KJ•mol-1.
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能.
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g)?3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是abd.
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与NO2体积比保持不变
d.体系压强保持不变
②在某温度下,5L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/mol 时间 | n (N2H4) | n (NO2) | n (N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,如图3所示.该电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
20.下列关于厨房中的化学不符合科学道理的是( )
| A. | 鸡蛋和牛奶都含有大量蛋白质,可以在微波炉中加热牛奶和完整的鸡蛋 | |
| B. | 炒菜时油锅着火可以迅速盖上锅盖 | |
| C. | 天然气、沼气主要成分是甲烷,液化石油气的主要成分是丙烷、丁烷等 | |
| D. | 桌台抹布上有很多油污,放进沸水中并加少量纯碱煮几分钟会变得很干净 |