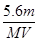题目内容
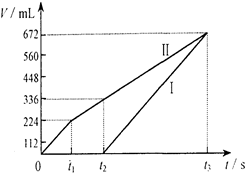
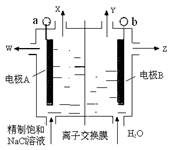
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。
⑴通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液的pH。
⑵实验中发现,阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。试简要分析其可能原因。

⑴通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液的pH。
⑵实验中发现,阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。试简要分析其可能原因。
⑴①c(NaCl)=0.1mol/L c(CuSO4)=0.1mol/L ②pH=1
⑵产生的氯气和氧气在水中的溶解度明显大于氢气
⑵产生的氯气和氧气在水中的溶解度明显大于氢气
试题分析:电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系。
(1)①由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知
n(NaCl)=(0.224L÷22.4L/mol)×2=0.02mol
所以c(NaCl)=0.02mol÷0.2L=0.1mol/L
由t2时生成氧气为112mL,n(O2)=0.112L÷22.4L/mol=0.005mol
则共转移电子为0.02mol+0.005mol×4=0.04mol
根据电子守恒及Cu2++2e-=Cu可知
n(CuSO4)=0.04mol÷2=0.02mol
所以c(CuSO4)=0.02mol÷0.2L=0.1mol/L
②由t2时4OH--4e-=O2↑+2H2O~4H+可知
n(H+)=0.005mol×4=0.02mol
则溶液的c(H+)=0.02mol÷0.2L=0.1mol/L
所以pH=1
(2)由于产生的氯气和氧气在水中的溶解度明显大于氢气,所以阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。
点评:该题是中等难度的试题,试题综合性强,侧重对学生答题能力的培养。明确发生的电极反应及图象的对应关系是解答本题的关键,有利于调动学生的学习兴趣,激发学生的学习积极性,有利于提高学生应试能力,提升学生的学科素养。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
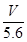 mol
mol