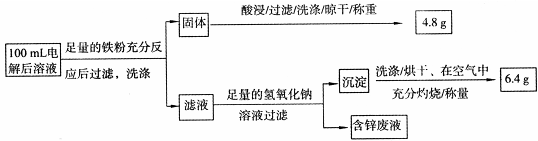
题目内容
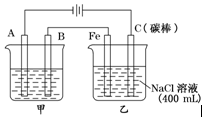
电解某含有等物质的量的Cu2+、Cl-、H+、SO42-的水溶液中,下列说法正确的是
| A.用石墨做电极时,首先在阴极放电的是Cl- |
| B.用石墨做电极时,电解一段时间后H+有可能在阴极放电 |
| C.用铁做电极时,阳极反应式:2Cl-—2e—=Cl2↑ |
| D.用石墨做电极时,开始电解时Cl-与H+首先放电 |
B
试题分析:如果用惰性电极电解含有等物质的量的Cu2+、Cl-、H+、SO42-的水溶液时,阳极首先是氯离子放电生成氯气,然后是OH-放电生成氧气。阴极首先是铜离子放电,析出铜。然后是氢离子放电,生成氢气,所以选项A、D不正确,B正确。如果用铁作电极,则阳极是铁失去电子,C不正确,答案选B。
点评:该题是中等难度的试题,也是高考中的常见考点和题型,侧重对学生灵活运用基础知识解决实际问题的能力的培养。该类试题的关键是明确离子的放电顺序,即在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。