题目内容
【题目】二氧化硫、氯气、氯化亚砜等均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)。
(1)在373K时,向10 L的密闭容器中通入SO2、SCl2与Cl2均为0.20 mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
I | p | 6.0p0 | 6.7 p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
请回答下列问题:
①该反应的ΔH ______________(填“>”“<”或“=”)0。
②I反应开始至达到平衡时,v(SOCl2)= ______________。
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是__________________。
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。
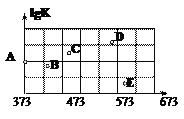
①A点的数值为______________。(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______________点。
(3)已知反应S4(g) +4Cl2(g) = 4SCl2(g) 的ΔH=-4kJ·mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJspan>、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为__________kJ
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为 Ka1= 1.54×10-2 、Ka2 = 1.02×10-7。10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)___________c(OH-)(大于、小于、等于,下同)
②当V= a mL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO32-)+c(HSO3-);当V= b mL时,溶液中离子浓度有如下关系:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3);则a _________b。
【答案】 < 0 5×10-3 molL-1min-1 加入了催化剂 2.6 B、E 243 大于 大于
【解析】试题分析:(1)反应达到平衡时的压强小于开始时的压强,物质的量减小,但开始1 min时压强大于开始的压强,说明容器内温度升高;根据同温同压下,压强比等于物质的量比,可知平衡时气体的物质的量是![]() ,利用“三段式” 计算v(SOCl2);由表格数据可以看出,改变条件反应速率加快,但平衡没移动。(2)根据(1)计算反应平衡常数;根据(1)可知SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)反应放热,升高温度平衡逆向移动,平衡常数减小;(3)根据焓变=反应物总键能-生成物总键能计算1molCl2(g)分子中化学键断裂时需吸收的能量;(4)10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=10mL时,溶质是NaHSO3,c(SO32-)>c(H2SO3),说明HSO3-电离大于水解;V= a mL时,根据电荷守恒c(Na+)=2c(SO32-)+c(HSO3-),说明c(H+)=c(OH-),溶液呈中性;V= b mL时c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),说明钠元素与硫元素的比为1:1,亚硫酸与氢氧化钠1:1反应,溶质是NaHSO3,溶液呈酸性;根据以上分析回答。
,利用“三段式” 计算v(SOCl2);由表格数据可以看出,改变条件反应速率加快,但平衡没移动。(2)根据(1)计算反应平衡常数;根据(1)可知SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)反应放热,升高温度平衡逆向移动,平衡常数减小;(3)根据焓变=反应物总键能-生成物总键能计算1molCl2(g)分子中化学键断裂时需吸收的能量;(4)10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=10mL时,溶质是NaHSO3,c(SO32-)>c(H2SO3),说明HSO3-电离大于水解;V= a mL时,根据电荷守恒c(Na+)=2c(SO32-)+c(HSO3-),说明c(H+)=c(OH-),溶液呈中性;V= b mL时c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),说明钠元素与硫元素的比为1:1,亚硫酸与氢氧化钠1:1反应,溶质是NaHSO3,溶液呈酸性;根据以上分析回答。
解析:(1)①气体物质的量减小,反应达到平衡时的压强小于开始时的压强,但开始1 min时压强大于开始的压强,说明容器内温度升高,所以正反应放热ΔH<0;②根据同温同压下,压强比等于物质的量比,可知平衡时气体的物质的量是![]() ,
,
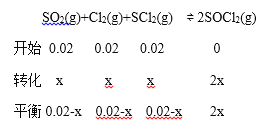
0.02-x+0.02-x+0.02-x+2x=0.05
x=0.01mol/L
v(SOCl2)= ![]() 5×10-3 molL-1min-1 ;③由表格数据可以看出,改变条件反应速率加快,但平衡没移动,所以可能是加入了催化剂。(2)①根据(1)的“三段式”
5×10-3 molL-1min-1 ;③由表格数据可以看出,改变条件反应速率加快,但平衡没移动,所以可能是加入了催化剂。(2)①根据(1)的“三段式”
平衡常数K=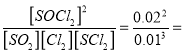 400,A点的数值
400,A点的数值![]() 2.6;②SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)反应放热,升高温度平衡逆向移动,平衡常数减小,所以
2.6;②SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)反应放热,升高温度平衡逆向移动,平衡常数减小,所以![]() 减小,选BE;(3)设1molCl2(g)分子中化学键断裂时需吸收的能量为xKJ,则-4=1064+4x-510kJ×4,解得x=243;(4)10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=10mL时,溶质是NaHSO3,c(SO32-)>c(H2SO3),说明HSO3-电离大于水解,则c(H+)大于c(OH-);V= a mL时, c(Na+)=2c(SO32-)+c(HSO3-),根据电荷守恒,说明c(H+)=c(OH-),溶液呈中性;V= b mL时c(Na+)=c(SO32-)+c(
减小,选BE;(3)设1molCl2(g)分子中化学键断裂时需吸收的能量为xKJ,则-4=1064+4x-510kJ×4,解得x=243;(4)10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=10mL时,溶质是NaHSO3,c(SO32-)>c(H2SO3),说明HSO3-电离大于水解,则c(H+)大于c(OH-);V= a mL时, c(Na+)=2c(SO32-)+c(HSO3-),根据电荷守恒,说明c(H+)=c(OH-),溶液呈中性;V= b mL时c(Na+)=c(SO32-)+c(

 阅读快车系列答案
阅读快车系列答案
