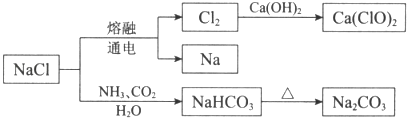
题目内容
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
【答案】C
【解析】A.氯气溶于水,部分与水反应,部分以氯气分子形式存在,依据氯原子个数守恒,将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和小于2NA,故A错误;B.100gCaCO3晶体的物质的量为1mol,含有1mol钙离子和1mol碳酸根离子;100gKHSO4晶体的物质的量为1mol,含有1mol钾离子和1mol硫酸氢根离子;离子数均为2NA,故B错误;C.标准状况下,4.48LNO和2.24LO2混合后,恰好反应生成4.48LNO2,物质的量为![]() =0.2mol,根据质量守恒定律,原子总数为0.6NA,故C正确;D.在反应3BrF3+5H2O=HBrO3+ Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用,所以5molH2O参加反应,则被水还原的BrF3的分子数目小于3NA,故D错误;故选C。
=0.2mol,根据质量守恒定律,原子总数为0.6NA,故C正确;D.在反应3BrF3+5H2O=HBrO3+ Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用,所以5molH2O参加反应,则被水还原的BrF3的分子数目小于3NA,故D错误;故选C。

【题目】二氧化硫、氯气、氯化亚砜等均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)。
(1)在373K时,向10 L的密闭容器中通入SO2、SCl2与Cl2均为0.20 mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
I | p | 6.0p0 | 6.7 p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
请回答下列问题:
①该反应的ΔH ______________(填“>”“<”或“=”)0。
②I反应开始至达到平衡时,v(SOCl2)= ______________。
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是__________________。
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为______________。(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______________点。
(3)已知反应S4(g) +4Cl2(g) = 4SCl2(g) 的ΔH=-4kJ·mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJspan>、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为__________kJ
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为 Ka1= 1.54×10-2 、Ka2 = 1.02×10-7。10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)___________c(OH-)(大于、小于、等于,下同)
②当V= a mL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO32-)+c(HSO3-);当V= b mL时,溶液中离子浓度有如下关系:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3);则a _________b。