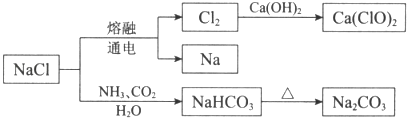
题目内容
【题目】氧元素和硫元素组成的两种物质发生化学反应的微观示意图如下所示,其中●表示硫原子,○表示氧原子. 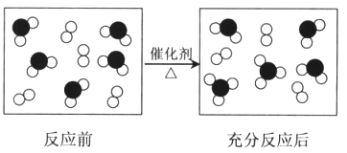
请回答下列问题:
(1)该反应的化学方程式是 .
(2)反应过程中,O2的浓度在5min内由5mol/L变成了1mol/L,用O2表示的化学反应速率是mol/(Lmin).
(3)在等温等容条件下,该反应达到化学平衡状态的依据是(填序号).
a.容器中压强不再改变
b.混合气体中c(O2)不再改变
c.c(SO2)=c(O2)
【答案】
(1)2SO2+O2 ![]() 2SO3
2SO3
(2)0.8
(3)ab
【解析】解:(1)根据图知,反应物是二氧化硫和氧气,该反应中参加反应的二氧化硫分子个数是2、参加反应的氧气分子个数是1、生成2个三氧化硫分子,且反应中还有剩余的二氧化硫和氧气,所以为可逆反应,据此确定方程式为2SO2+O2 ![]() 2SO3 , 所以答案是:2SO2+O2
2SO3 , 所以答案是:2SO2+O2 ![]() 2SO3;(2)氧气反应速率=
2SO3;(2)氧气反应速率= ![]() =
= ![]() mol/(L.min)=0.8mol/(L.min),所以答案是:0.8;(3)a.反应前后气体的物质的量减小导致压强减小,当容器中压强不再改变时达到平衡状态,故正确; b.混合气体中c(O2)不再改变时正逆反应速率相等,反应达到平衡状态,故正确; c.c(SO2)=c(O2)该反应不一定达到平衡状态,与反应物浓度及转化率有关,所以不能据此判断平衡状态,故错误;故选ab.
mol/(L.min)=0.8mol/(L.min),所以答案是:0.8;(3)a.反应前后气体的物质的量减小导致压强减小,当容器中压强不再改变时达到平衡状态,故正确; b.混合气体中c(O2)不再改变时正逆反应速率相等,反应达到平衡状态,故正确; c.c(SO2)=c(O2)该反应不一定达到平衡状态,与反应物浓度及转化率有关,所以不能据此判断平衡状态,故错误;故选ab.
【考点精析】解答此题的关键在于理解化学平衡状态的判断的相关知识,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

 阅读快车系列答案
阅读快车系列答案【题目】二氧化硫、氯气、氯化亚砜等均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)。
(1)在373K时,向10 L的密闭容器中通入SO2、SCl2与Cl2均为0.20 mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
I | p | 6.0p0 | 6.7 p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
请回答下列问题:
①该反应的ΔH ______________(填“>”“<”或“=”)0。
②I反应开始至达到平衡时,v(SOCl2)= ______________。
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是__________________。
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为______________。(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______________点。
(3)已知反应S4(g) +4Cl2(g) = 4SCl2(g) 的ΔH=-4kJ·mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJspan>、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为__________kJ
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为 Ka1= 1.54×10-2 、Ka2 = 1.02×10-7。10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)___________c(OH-)(大于、小于、等于,下同)
②当V= a mL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO32-)+c(HSO3-);当V= b mL时,溶液中离子浓度有如下关系:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3);则a _________b。