题目内容
【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O,利用硼镁矿制取金属镁及粗硼的工艺流程如下,请回答下列有关问题:
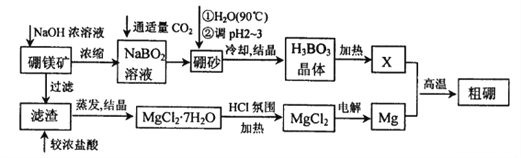
(1)硼砂中B的化合价为_________;滤渣的主要成分为_______________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_________________________。
(3)H3BO3是一种一元弱酸,也可写作B(OH)3,它与水作用时结合水电离的OH-而呈酸性,这一变化的离子方程式为______________________________。
(4)MgCl2·6H2O需要在HCl氛围中加热,其目的是______________________。
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为_______________。
【答案】 +3 Mg(OH)2 3Mg+B2O3![]() 2B+3MgO H3BO3+H2O
2B+3MgO H3BO3+H2O![]() [B(OH)4]-+H+ 防止MgCl2水解生成Mg(OH)2 蓝色
[B(OH)4]-+H+ 防止MgCl2水解生成Mg(OH)2 蓝色
【解析】(1)硼砂的化学式为Na2B4O710H2O,钠元素化合价为+1价,氧元素化合价-2价,依据化合价代数和计算得到硼元素化合价为+3价;根据题意,硼镁矿(Mg2B2O5H2O)中加入氢氧化钠反应生成的滤渣用盐酸溶解后生成氯化镁,故滤渣为氢氧化镁,故答案为:+3;Mg(OH)2;
(2)X为H3BO3晶体加热脱水的产物,应为B2O3,B2O3与Mg反应制取粗硼与氧化镁,反应方程式为B2O3+3Mg![]() 2B+3MgO,故答案为:B2O3+3Mg
2B+3MgO,故答案为:B2O3+3Mg![]() 2B+3MgO;
2B+3MgO;
(3)H3BO3是一种一元弱酸,也可写作B(OH)3,它与水作用时结合水电离的OH-而呈酸性,反应的离子方程式为H3BO3+H2O![]() [B(OH)4]-+H+,故答案为:H3BO3+H2O
[B(OH)4]-+H+,故答案为:H3BO3+H2O![]() [B(OH)4]-+H+;
[B(OH)4]-+H+;
(4)MgCl27H2O需要在HCl氛围中加热,是为了防止氯化镁水解生成氢氧化镁,故答案为:防止MgCl2水解生成Mg(OH)2;
(5)25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12,根据平衡Mg(OH)2(s)Mg2++2OH-可得:c(Mg2+)c2(OH-)=5.6×10-12,设c(OH-)=2c(Mg2+)=x,则:0.5x×x2=5.6×10-12,解得:x=2.24×10-4mol/L,c(H+)=![]() mol/L=4.5×10-11mol/L,溶液的pH=10.4>9.6,所以溶液呈蓝色,故答案为:蓝色。
mol/L=4.5×10-11mol/L,溶液的pH=10.4>9.6,所以溶液呈蓝色,故答案为:蓝色。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】常温下,回答下列关于酸和碱中和反应的问题:
将某一元酸HA 和NaOH溶液等体积混合,分别进行编号①、②、③的实验,实验数据记录事表
序号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>9 |
请回答:
(1)根据①组实验情况,混合溶液pH=9的原因是_____________(用离子方程式表示)。
(2)混合溶液①中由水电离出的c (H+)_____0.1moI/LNaOH溶液中由水电离出的c(H+)。(填“>”“<”或“=”)
(3)根据①组实验情况,在该溶液中下列关系式正确的是(填序号字母)______。
A.c(Na+)+c(H+) =c(OH-) +c(A-)
B.c(Na+) =c(HA) +c(A-)
C.c (HA)+c(H+) =c(OH-)
D.c(Na+) +c(H+) =c(OH-) +c(A-) +c (HA)
(4)②组情况表明,c_________0.2mol/L (选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)____c(Na+) (选填“>”、“<”或“=”)。
(5)从③组实验结果分析,离子浓度由大到小的顺序是_________________________。