题目内容
【题目】NH4Al(SO4)2在食品、医药、电子工业中用途广泛。回答下列问题:
(1)NH4Al(SO4)2可做净水剂,其理由是____________________(用离子方程式表示)。
(2)相同条件下,0.1mol/LNH4Al(SO4)2溶液中,c(NH4+)_____0.1mol/LNH4HSO4溶液中c(NH4+)(填“大于”、“等于”或“小于”)。
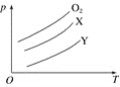
(3)下图是0.1mol/L 电解质溶液的pH 随温度变化的图像。

①其中符合0.1mol/LNH4Al(SO4)2溶液的是________(填字母)。导致溶液pH随温度变化的原因是_____________________________。
②20℃时,0.1mol/LNH4Al(SO4)2溶液中,2c(SO42-)-c(NH4+) -3c(Al3+)=_____mol/L。
(4)室温时,向0.1mol/LNH4Al(SO4)2溶液中滴加0.1mol/LNaOH 溶液。得到溶液pH与NaOH溶液体积关系曲线如图所示:
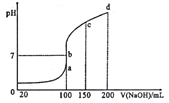
①已知:Ksp[Al(OH)3]=1×10-33,Al3+沉淀完全时(使其浓度小于1×10-6mol·L-1),溶液的pH=_______,试分析图中a、b、c、d四点,水的电离程度最大的是______________________。
②在b点,溶液中各离子浓度由大到小的顺序是_______________。
③b-c段随着NaOH的加入,溶液中c(NH3·H2O)/c(OH-)的值_____(填“增大”、“减小”或 “不变”)。
【答案】 Al3++3H2O![]() A(OH)3(胶体)+3H+ 小于 I 升温使NH4Al(SO4)2水解平衡向正反应方向移动,pH降低 10-3或(10-3-10-11) 5 a c(Na+) > c(SO42-) > c(NH4+) > c(OH-)= c(H+) 减小
A(OH)3(胶体)+3H+ 小于 I 升温使NH4Al(SO4)2水解平衡向正反应方向移动,pH降低 10-3或(10-3-10-11) 5 a c(Na+) > c(SO42-) > c(NH4+) > c(OH-)= c(H+) 减小
【解析】本题主要考查有关盐类水解及中和反应的判断及计算。
(1)NH4Al(SO4)2可做净水剂,其理由是铝离子水解生成的氢氧化铝胶体能吸附除去水中的悬浮杂质,Al3++3H2O![]() A(OH)3(胶体)+3H+。
A(OH)3(胶体)+3H+。
(2) NH4HSO4溶液中大量H+抑制NH4+水解,所以相同条件下,0.1mol/LNH4Al(SO4)2溶液中,c(NH4+)小于0.1mol/LNH4HSO4溶液中c(NH4+)。
(3)①其中符合0.1mol/LNH4Al(SO4)2溶液的是I。导致溶液pH随温度变化的原因是升温使NH4Al(SO4)2水解平衡向正反应方向移动,pH降低。
②溶液中电荷守恒:2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+ c(H+),由此可得2c(SO42-)-c(NH4+)-3c(Al3+)= c(H+)-c(OH-)=10-3或(10-3-10-11) mol/L。
(4)①已知:Ksp[Al(OH)3]=1×10-33,Al3+沉淀完全时,c(Al3+ )< 10-6mol/L,c(OH-)>( 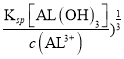 =10-9mol/L,溶液的pH=5。
=10-9mol/L,溶液的pH=5。
依次发生反应:Al3++3OH-![]() Al(OH)3↓ 和
Al(OH)3↓ 和![]() +OH-
+OH-![]() NH3·H2O ,图中b点时溶液中存在
NH3·H2O ,图中b点时溶液中存在![]() 和NH3·H2O,a点
和NH3·H2O,a点![]() 水解使溶液呈酸性,b、c、d 点含有的NH3·H2O越来越多,盐类水解促进水的电离,酸、碱抑制水的电离,因此, a、b、c、d四点,水的电离程度最大的是a。
水解使溶液呈酸性,b、c、d 点含有的NH3·H2O越来越多,盐类水解促进水的电离,酸、碱抑制水的电离,因此, a、b、c、d四点,水的电离程度最大的是a。
②在b点,溶液中存在Na2SO4、(NH4)2SO4、NH3·H2O,各离子浓度由大到小的顺序是c(Na+) > c(SO42-) > c(NH4+) > c(OH-)= c(H+)。
③b-c段随着NaOH的加入,c(NH3·H2O)越来越大,电离程度越来越小,所以溶液中c(NH3·H2O)/c(OH-)的值减小。

【题目】常温下,回答下列关于酸和碱中和反应的问题:
将某一元酸HA 和NaOH溶液等体积混合,分别进行编号①、②、③的实验,实验数据记录事表
序号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>9 |
请回答:
(1)根据①组实验情况,混合溶液pH=9的原因是_____________(用离子方程式表示)。
(2)混合溶液①中由水电离出的c (H+)_____0.1moI/LNaOH溶液中由水电离出的c(H+)。(填“>”“<”或“=”)
(3)根据①组实验情况,在该溶液中下列关系式正确的是(填序号字母)______。
A.c(Na+)+c(H+) =c(OH-) +c(A-)
B.c(Na+) =c(HA) +c(A-)
C.c (HA)+c(H+) =c(OH-)
D.c(Na+) +c(H+) =c(OH-) +c(A-) +c (HA)
(4)②组情况表明,c_________0.2mol/L (选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)____c(Na+) (选填“>”、“<”或“=”)。
(5)从③组实验结果分析,离子浓度由大到小的顺序是_________________________。