题目内容
【题目】下列有关电解质溶液的说法正确的是
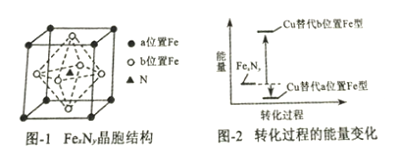
A. 向0.1mol/L CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/[c(CH3COOH).c(OH-)]增大
C. 向盐酸中加入氨水至中性,溶液中[c(NH4+)/c(Cl-)]>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c(Cl-)/c(Br-)不变
【答案】D
【解析】A. 向0.1mol/L CH3COOH溶液中加入少量水,电离常数Ka=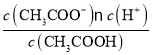 不变,c(CH3COO-)减小,所以溶液中c(H+)/c(CH3COOH)增大,故A错误;B. 升温CH3COONa的水解程度增大,水解常数Kh=
不变,c(CH3COO-)减小,所以溶液中c(H+)/c(CH3COOH)增大,故A错误;B. 升温CH3COONa的水解程度增大,水解常数Kh=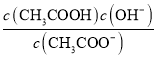 增大,所以溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]减小,故B错误;C. 向盐酸中加入氨水至中性,c(OH-) c(H+),溶液中电荷守恒:c(OH-) +c(Cl-)=c(H+)+ c(NH4+),因此, c(NH4+)=c(Cl-)即 [c(NH4+)/c(Cl-)]=1,故C错误;D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,产生AgCl、AgBr沉淀,溶液仍然是AgCl、AgBr的饱和溶液,溶液中
增大,所以溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]减小,故B错误;C. 向盐酸中加入氨水至中性,c(OH-) c(H+),溶液中电荷守恒:c(OH-) +c(Cl-)=c(H+)+ c(NH4+),因此, c(NH4+)=c(Cl-)即 [c(NH4+)/c(Cl-)]=1,故C错误;D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,产生AgCl、AgBr沉淀,溶液仍然是AgCl、AgBr的饱和溶液,溶液中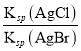 =c(Cl-)/c(Br-)不变,故D正确。故选D。
=c(Cl-)/c(Br-)不变,故D正确。故选D。

【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,要进行必要的处理。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ: 取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1 Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3
2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1 Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3![]() 2NaI+Na2S4O6)
2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | 18.20 |
步骤Ⅳ:将上述反应后溶液进行pH调节、过滤等处理,回收沉淀,滤液倒入下水道。
(1)步骤Ⅰ加入稀硫酸酸化的目的是_____________________________;
(2)步驟Ⅱ判断滴定达到终点的现象是___________________________;
(3)以下操作会造成废水中铬含量测定值偏高的是_________________;
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72- 的物质的量为___________mol.
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:

(5)能说明第①步反应达到平衡状态的是_____________;(填字母代号)
a. Cr2O72- 和CrO42- 的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c. 溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要________mol的FeSO4·7H2O。
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol·L-1,溶液的pH应调至___________。
【题目】硫的化合物在科研、生活及化学工业中具有重要的作用。
(1)在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ (mol·L-1) | 1.4×10-15 | 1.4×10-11 | 6.8×10-8 | 1.3×10-5 | 1.3×10-3 |
某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液的pH=5时,Mn2+开始沉淀,MnS的溶度积为______。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g) ΔH1,在膜反应器中分离出H2。
2H2(g)+S2(g) ΔH1,在膜反应器中分离出H2。
①已知:H2S(g)![]() H2(g)+S(g) ΔH2;2S(g)
H2(g)+S(g) ΔH2;2S(g)![]() S2(g) ΔH3,则ΔH1=______ (用含ΔH2、ΔH3的式子表示)。
S2(g) ΔH3,则ΔH1=______ (用含ΔH2、ΔH3的式子表示)。
②在密闭容器中,充入0.10 mol H2S(g),发生反应2H2S(g)![]() 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图所示。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图所示。
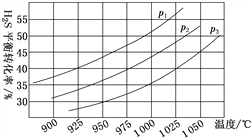
图中压强p1、p2、p3由大到小的顺序为______,理由是______。若容器的容积为2.0 L,则压强为p3,温度为950 ℃时,反应经3 h达到平衡,化学反应速率v(S2)=______;若压强p2=7.2 MPa、温度为975 ℃时,该反应的平衡常数Kp=______(用平衡分压代替平衡浓度,分压=总压×物质的量分数,计算结果保留两位有效数字)。若保持压强不变,升温至1000 ℃时,则该反应的平衡常数_____(填“增大”“不变”或“减小”)。
(3)工业上用惰性电极电解KHSO4饱和溶液制取H2O2,示意图如图所示:
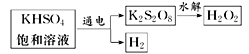
①低温电解KHSO4饱和溶液时阳极的电极反应式为______。
②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式______。
【题目】常温下,回答下列关于酸和碱中和反应的问题:
将某一元酸HA 和NaOH溶液等体积混合,分别进行编号①、②、③的实验,实验数据记录事表
序号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>9 |
请回答:
(1)根据①组实验情况,混合溶液pH=9的原因是_____________(用离子方程式表示)。
(2)混合溶液①中由水电离出的c (H+)_____0.1moI/LNaOH溶液中由水电离出的c(H+)。(填“>”“<”或“=”)
(3)根据①组实验情况,在该溶液中下列关系式正确的是(填序号字母)______。
A.c(Na+)+c(H+) =c(OH-) +c(A-)
B.c(Na+) =c(HA) +c(A-)
C.c (HA)+c(H+) =c(OH-)
D.c(Na+) +c(H+) =c(OH-) +c(A-) +c (HA)
(4)②组情况表明,c_________0.2mol/L (选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)____c(Na+) (选填“>”、“<”或“=”)。
(5)从③组实验结果分析,离子浓度由大到小的顺序是_________________________。